Revista Ciencia & Salud: Integrando Conocimientos / Agosto - Setiembre 2020 / Volumen 4 / Número 4
Integrando Conocimientos
Diagnóstico diferencial de infertilidad femenina:
Síndrome de Ovario Poliquístico e Hiperplasia
Suprarrenal Congénita No Clásica.
Revisión Bibliográfica.
Differential diagnosis of female infertility: Polycystic
ovary syndrome and Non-classical Congenital Adrenal
Hyperplasia. A literature review.
Pág. 195, 205
Recibido: 20-05-2020
Aceptado: 13-07-2020
María Angélica Montero-Rojas1
Daniela Gallardo-Madrigal2
1,2,3,4. Médico General, Trabajador Independiente. San José,Costa Rica.
CONFLICTOS DE INTERÉS
corresponde al síndrome de ovario poliquístico
(SOP) el cual se traslapa fenotípicamente con
Ninguno
la hiperplasia suprarrenal congénita no clásica
(HSC-NC), por lo que el diagnóstico diferencial
FINANCIAMIENTO
entre estos entes se considera mandatorio.
El SOP, caracterizado por oligoanovulación,
La presente investigación no ha recibido ayudas
hiperandrogenismo y folículos ováricos en el
específicas provenientes de agencias del sector
ultrasonido, se presenta hasta en un 90-95% de
público, sector comercial o entidades sin ánimo
las pacientes que buscan tratamiento para su
de lucro.
condición de infertilidad. Por su parte, la HSC-NC
RESUMEN
es el trastorno de esteroidogénesis genético más
común que afecta la fertilidad. Factores como el
La infertilidad femenina afecta aproximadamente
hiperandrogenismo, desórdenes hormonales,
a un 13% de las mujeres en edad reproductiva
alteraciones anatómicas y el índice de masa
globalmente. La causa endocrina más frecuente
corporal juegan un papel en las anormalidades
195
Revista Ciencia & Salud: Integrando Conocimientos / Agosto - Setiembre 2020 / Volumen 4 / Número 4
Integrando Conocimientos
reproductivas que son comunes entre estos
NC-CAH, Polycystic Ovary Syndrome, PCOS.
dos trastornos endocrinos. El objetivo de esta
revisión es discutir las diferencias y similitudes
INTRODUCCIÓN
en los mecanismos implicados en el desarrollo
de infertilidad de ambos síndromes para realizar
La infertilidad o subfertilidad se refiere a la
un adecuado diagnóstico diferencial.
incapacidad de una pareja para establecer un
embarazo clínico después de
12 meses de
PALABRAS CLAVE
relaciones sexuales regulares sin protección
debido a un deterioro de la capacidad
Infertilidad
femenina, hiperandrogenismo,
de reproducción de una persona, ya sea
hiperplasia suprarrenal congénita no clásica,
individualmente o con su pareja(1,2). Se puede
HSC-NC, Síndrome de Ovario Poliquístico, SOP.
clasificar en primaria, en el caso de parejas
que nunca han concebido; y secundaria, en
ABSTRACT
parejas que han logrado la concepción en
algún momento(2). Se estima que en países
Female infertility affects globally approximately
en desarrollo una de cada cuatro parejas en
13% of women of reproductive age. Polycystic
edad reproductiva padecen de infertilidad(1).
ovary syndrome (PCOS) is the most frequent
Aproximadamente un
13% de las mujeres
endocrine cause, which phenotypically overlaps
globalmente padecen de infertilidad, siendo la
with non-classical congenital adrenal hyperplasia
secundaria la forma más común (1,2).
(NC-CAH), so the differential diagnosis between
these entities is considered mandatory.
La infertilidad femenina se debe en su vasta
PCOS, characterized by oligoanovulation,
mayoría a una disfunción ovulatoria (2), cuya
hyperandrogenism, and ovarian follicles on
causa endocrina más frecuente en mujeres en
ultrasound, occurs in up to 90-95% of patients
edad reproductiva corresponde al síndrome
seeking treatment for their infertility condition.
de ovario poliquístico (SOP)(1,3,4). Debido al
Meanwhile, HSC-NC is the most common
gran parecido fenotípico de este síndrome con
genetic steroid disorder that affects fertility.
la hiperplasia suprarrenal congénita no clásica
Factors such as hyperandrogenism, hormonal
(HSC-NC), el diagnóstico diferencial entre estos
anomalies, anatomical alterations and the
dos trastornos es mandatorio en el contexto de
body mass index play a role in the reproductive
infertilidad femenina (5). Por tanto, el objetivo
abnormalities that are common between these
de esta revisión es discutir las diferencias y
two endocrine disorders. The objective of
similitudes en los mecanismos implicados en el
this review is to discuss the differences and
desarrollo de infertilidad de ambos síndromes
similarities in the mechanisms involved in the
para realizar un adecuado diagnóstico
development of infertility of both syndromes to
diferencial.
make an adequate differential diagnosis.
El SOP se caracteriza por oligoovulación y/o
KEYWORDS
anovulación, signos químicos o bioquímicos
de hiperandrogenismo y la visualización de
Female
infertility,
hyperandrogenism,
folículos ováricos en ultrasonido; características
nonclassical congenital adrenal hyperplasia,
que a su vez forman parte de los criterios de
196
Revista Ciencia & Salud: Integrando Conocimientos / Agosto - Setiembre 2020 / Volumen 4 / Número 4
Integrando Conocimientos
Rotterdam (6-8). Este síndrome corresponde
recién nacidos no revela una 17-OHP elevada,
a la principal causa de hiperandrogenismo
además de que esta condición no cursa con
y oligoanovulación que asocia infertilidad y
ambigüedad genital al nacimiento
(13). Este
desórdenes metabólicos, dentro de los cuales
desorden se presenta con varios grados
predomina la resistencia a la insulina, intolerancia
de virilización postnatal de acuerdo con la
a la glucosa y diabetes mellitus tipo 2. Además,
gravedad del defecto; puede ser asintomática
conlleva implicaciones de por vida al aumentar
(12); con manifestaciones en la adolescencia y
el riesgo de infertilidad, hiperplasia endometrial,
en mujeres jóvenes como hiperandrogenismo,
desórdenes metabólicos, carcinoma endometrial
oligoovulación, pubarca precoz, cuadro clínico
y enfermedad cardiovascular (4,6,9).
similar al SOP e infertilidad; o bien, en casos
más graves, desde la infancia con síntomas
El SOP abarca múltiples factores reproductivos
como pubarca prematura, acné y edad ósea
y metabólicos, y globalmente afecta cerca de un
acelerada (13).
4-18% de las mujeres. Además, la fertilidad de
estas pacientes puede verse afectada de forma
INFERTILIDAD FEMENINA EN SOP E HSC-NC
negativa por el estado individual de sobrepeso,
hiperandrogenismo y concentraciones elevadas
El SOP es la principal causa de infertilidad
de hormona luteinizante (3,4,10).
anovulatoria, hasta un 90-95% de las pacientes
que buscan tratamiento para su condición
La hiperplasia suprarrenal congénita
(HSC)
de infertilidad lo presentan. Una de las
es un trastorno autosómico recesivo, causado
implicaciones reproductivas más importantes
por una esteroidogénesis defectuosa en la
es el riesgo de pérdida gestacional temprana;
corteza suprarrenal. Más del
90% de los
además de que usualmente les toma más
casos son causados por la deficiencia de la
tiempo lograr el embarazo (4,16,17). De manera
enzima
21-hidroxilasa(11). La anormalidad
general se ve caracterizado por anovulación
bioquímica más característica es la elevación
fisiológica, elevación de la hormona luteinizante
de
17-hidroxiprogesterona
(17-OHP), el
(LH), hiperandrogenismo y anormalidades
sustrato principal de la
21 hidroxilasa; lo
en la frecuencia de pulsaciones de hormona
que desplaza el eje hacia la producción de
liberadora de gonadotropina
(GnRH). Estas
androstenediona y testosterona (12). La HSC-
alteraciones bioquímicas se manifiestan como
NC es una forma leve de HSC, ya que presenta
acné, hirsutismo, entre otros (6,7,9).
una actividad enzimática residual del 20 al 60%
(5,13). Corresponde a uno de los trastornos
Por su parte, la HSC es el trastorno de
autosómicos recesivos más comunes y es el
esteroidogénesis genético más común que
trastorno esteroidal genético más frecuente
afecta la fertilidad. Las hormonas esteroideas
(13,14).
suprarrenales son esenciales para el desarrollo
sexual normal y la función reproductiva. Esta
Se estima que la prevalencia de HSC-NC es de
infertilidad se ha explicado por alteraciones
1 en 600, dependiendo de la etnia; (11,12); y
del eje hipotálamo-hipófisis-ovario
(HHO),
del 1-10% en mujeres con hiperandrogenismo
desencadenado por andrógenos elevados,
(15). Sin embargo, existe una subestimación
progesterona aumentada, expresión de
considerable debido a que el cribado de
5α-reductasa en el ovario e incluso como un
197
Revista Ciencia & Salud: Integrando Conocimientos / Agosto - Setiembre 2020 / Volumen 4 / Número 4
Integrando Conocimientos
efecto glucocorticoide directo (11).
la literatura menciona que este es causado
primariamente por un desequilibrio o defecto
Existe una correlación entre la gravedad del
celular tecal y disfunción del eje HHO, este
defecto enzimático y la tasa de embarazo
último manifestándose con una adrenarca
espontáneo y fertilidad en mujeres con HSC. La
prematura como signo temprano
(6,9). El
verdadera tasa de fertilidad en mujeres con HSC-
mecanismo de la anovulación no se le atribuye
NC es difícil de obtener debido al subestimación
a los andrógenos dado que se encuentran altos
de esta condición (18). Se ha reportado que
niveles de andrógenos en portadoras de SOP
hasta en el 13% de los casos de NC-CAH la
sin que esto sea la causa de la anovulación(19).
infertilidad es el síntoma de presentación (13).
Existe evidencia que al menos un tercio de las
Más del 30-50% de los pacientes con NCAH
pacientes presentan disfunción adrenocortical
muestran disfunción ovulatoria y menstrual (15).
en la formación de andrógenos, con un exceso
de sulfato de dihidroepiandrosterona (DHEAS).
Las mujeres con HSC-NC tienen menos
Sin embargo, el rol de los andrógenos adrenales
posibilidades de presentar anovulación; mientras
como causante de infertilidad en el SOP
que en el SOP está representa el 70-90% de
sigue sin ser confirmado. Por el contrario, el
los trastornos ovulatorios. Alrededor del 50%
hiperandrogenismo es el factor más destacado
de las mujeres con SOP presentan infertilidad
que contribuye en la infertilidad de mujeres con
primaria y el 25% infertilidad secundaria. En
HSC-NC (18).
cambio, solo el 17% de las mujeres con HSC-
NC tienen irregularidades menstruales. Además,
En cuanto a la HSC-NC, los niveles séricos de
la subfertilidad en mujeres con HSC-NC es
DHEAS son generalmente normales, mientras
más leve y muchas mujeres llegan a concebir
que la androstenediona, la testosterona y la
espontáneamente (5). Aunado a la infertilidad,
dihidrotestosterona
(DHT) están elevados,
estos padecimientos se relacionan con otras
pero son similares a los niveles encontrados en
condiciones que complican el embarazo. Las
pacientes con SOP (15). El hiperandrogenismo
mujeres con SOP poseen un alto riesgo de
en la HSC-NC resulta de la hiperactividad
parto prematuro, preeclampsia y diabetes
suprarrenal, de una mayor conversión periférica
gestacional durante el embarazo. La tasa de
de metabolitos esteroides a andrógenos y
aborto espontáneo es 20-40% más alta que las
del aumento de la secreción de andrógenos
mujeres sanas. Por su parte, en pacientes con
ováricos
(15). La elevación androgénica
HSC-NC existe un riesgo significativo de aborto
produce alteraciones del eje HHO, altera las
espontáneo, aproximadamente del 25% (5).
vías normales de retroalimentación central
e interfiere con la generación del pulso de la
Mecanismos implicados en la infertilidad
hormona liberadora de gonadotropina (GnRH),
lo cual dificulta la ovulación (18). Sin embargo,
1. Hiperandrogenismo
existe discusión sobre el mecanismo exacto
por el cual los andrógenos alteran el eje HHO.
La etiología pura de la hiperandrogenemia en
Mujeres con HSC-NC que reciben tratamiento
el SOP se desconoce, se sabe que factores
con esteroides normalizan los niveles de LH y
ambientales pueden influir. Sin embargo,
la capacidad de respuesta de LH a los pulsos
198
Revista Ciencia & Salud: Integrando Conocimientos / Agosto - Setiembre 2020 / Volumen 4 / Número 4
Integrando Conocimientos
de GnRH. No obstante, cuando se ha utilizado
términos de producción de estradiol y tienden
andrógenos como tratamiento en mujeres con
a presentar una respuesta inapropiada a LH, lo
SOP no se ha alterado la secreción basal de
que se cree provoca una diferenciación de la
LH, aunque las dosis altas de andrógenos sí
granulosa que resulta en un arresto prematuro
redujeron ligeramente la concentración de la
en el crecimiento folicular (19).
FSH (13).
Las pacientes portadoras de SOP presentan
También se ha propuesto que los andrógenos
niveles elevados de LH en contraste con FSH
poseen un efecto directo sobre el ovario, pues
los cuales se encuentran disminuidos
(7,8).
se ha visto que afectan la foliculogénesis
El aumento de los niveles de LH estimulan la
(18). Se ha demostrado que los andrógenos
secreción de andrógenos por parte de las células
suprarrenales elevados inhiben la actividad de
de la teca, lo que resulta en la hiperandrogenemia
la aromatasa de las células de la granulosa (13).
que caracteriza el síndrome. Otros factores como
Los andrógenos actúan como moduladores
el aumento de insulina circulante, desregulación
complejos de la esteroidogénesis ovárica debido
de factores moduladores de reclutamiento y
a la inhibición de la formación de receptores de
crecimiento de folículos, proteínas y citoquinas
LH, estimulados por la FSH, en las células de
pueden influir en el desarrollo folicular anormal
la granulosa, cuyos efectos varían de acuerdo
(9).
al alcance y la duración de la exposición a los
andrógenos (13,18).
En cuanto a la HSC-NC, la anovulación es
la principal causa de subfertilidad en estas
2. Otros factores hormonales
mujeres, lo cual es más evidente por la respuesta
positiva a la inducción de la ovulación (15). La
El SOP es el desorden hormonal más común,
evidencia indica que existe una hipersecreción
causante de infertilidad por anovulación en un
de LH, similar al SOP. El exceso de andrógenos
80% de las mujeres (7,9). La infertilidad puede
deteriora la sensibilidad del hipotálamo a la
ser parcialmente explicada por la exposición a
progesterona, lo que aumenta la frecuencia de
factores ambientales y desbalances hormonales.
los pulsos de la GnRH y resulta en una secreción
Como previamente se describió, la clínica
preferencial de la LH. La hipersecreción de LH
se caracteriza por oligoanovulación, la cual
aumenta la producción de andrógenos ováricos
puede presentar diferentes patrones clínicos y
y se potencian los efectos de los andrógenos
anormalidades en el ciclo menstrual (7,10,19).
suprarrenales
(11). En comparación con
Se sugiere que el arresto en el crecimiento
los controles, las mujeres con HSC-NC han
de folículos antrales y la anovulación son
aumentado la amplitud del pulso de LH pero a
consecuencia de un desarreglo temprano en el
intervalos normales (18).
desarrollo del folículo, e inclusive pueden influir
factores paracrinos a nivel de líquido folicular
Por otro lado, la aromatización del exceso de
que contribuyen a este arresto (19,20). Se ha
andrógenos aumenta los niveles de estrógenos
demostrado que pacientes portadoras de SOP
circulantes, los cuales pueden suprimir el
con ciclos anovulatorios poseen células de la
eje HHO, conducir a la anovulación y a ciclos
granulosa con una hiperrespuesta a la FSH en
menstruales irregulares
(18). Asimismo, las
199
Revista Ciencia & Salud: Integrando Conocimientos / Agosto - Setiembre 2020 / Volumen 4 / Número 4
Integrando Conocimientos
mujeres con HSC-NC cursan con niveles
Por su parte, dado que en la HSC-NC la
elevados de progesterona consistentemente
deficiencia enzimática es leve, la elevación de
a lo largo del ciclo, en contraste con el patrón
los andrógenos no se traduce en el desarrollo
bifásico normal de pacientes sanas. Esto altera
de anormalidades genitales intra útero
(18).
la calidad de los ovocitos y la frecuencia del
Sin embargo, un porcentaje de pacientes con
pulso de la GnRH, lo que puede impedir la
HSC-NC cursan con tumores ováricos de
ovulación e implantación. Tanto la progesterona
restos suprarrenales, los cuales se cree que
como la
17-OHP pueden convertirse en
son un contribuyente significativo en la génesis
andrógenos más potentes como la DHT (15).
de la subfertilidad (18). Además, estudios han
También, la progesterona actúa como una forma
encontraron ovarios agrandados en el 44% de
de anticoncepción ya que altera la motilidad
las mujeres adultas con HSC-NC estudiadas.
tubárica, espesa el moco cervical, y disminuye
la receptividad endometrial (11,18).
Esto se debe a que la acción de los andrógenos
conduce al engrosamiento de la cápsula ovárica,
un aumento general en el tamaño del ovario
y una expansión en el número de folículos
3. Alteraciones anatómicas
preantrales (13).
Estudios han demostrado la relación entre
3.1 Morfología ovárica
anormalidades uterinas y el SOP (16).Durante
el desarrollo embrionario del feto femenino los
El ultrasonido transvaginal
(TVS) es una
conductos mullerianos están separados por
herramienta para el diagnóstico de SOP,
un septo, el cual origina un útero inicialmente
pues evidencia una morfología poliquística
septado. Sin embargo, este septo sufre lisis
ovárica y oligoovulación en ausencia de otros
mediante múltiples mecanismos de apoptosis.
procesos causantes. Los criterios de Rotterdam
establecen la definición de ovario poliquístico
Las anormalidades en la fusión o desaparición
como la presencia de más de 12 folículos de
de estos conductos mullerianos puede resultar
2-9mm de diámetro apreciados como quistes en
en una variedad de anomalías. A pesar de que
la corteza ovárica, al menos en un ovario y/o un
el útero y los ovarios tienen origen embrionario
volumen ovárico mayor a 10cm3 (10ml) (4,7).
distinto, la relación antes mencionada podría
reflejar un desarrollo común de etiopatogénesis
Los ovarios poliquísticos en la ecografía son
entre el útero y el ovario, que requiere ser
más comunes en el SOP que en la HSC-NC
investigado con más profundidad.
(70% frente a
40%, respectivamente). Por
lo tanto, la apariencia ecográfica de ovarios
Los estudios acusan a la genética como principal
poliquísticos no es una característica específica
responsable de estas anomalías; pues tres
en el SOP (5). La asociación con anovulación
cuartas partes de las pacientes que cursan con
crónica y ciclos menstruales irregulares en HSC
alteraciones estructurales uterinas presentan
puede disminuir aún más la fecundidad de estas
SOP, lo que aumenta el número de abortos, y
mujeres (11).
con ello afecta la tasa de fertilidad (16).
200
Revista Ciencia & Salud: Integrando Conocimientos / Agosto - Setiembre 2020 / Volumen 4 / Número 4
Integrando Conocimientos
4. Índice de masa corporal
siglas en inglés); lo que se cree influye en el
desarrollo embrionario y altera el metabolismo
El rol del índice de masa corporal (IMC) abarca
de lípidos y glucosa. Además, produce una
los demás factores previamente mencionados,
disfunción esteroidogénica de óvulos y de la
dado que los impactos de la combinación de
potencial receptividad del endometrio, por lo
obesidad y desórdenes alimenticios exacerban
que estas pacientes presentan un impacto
la morbilidad reproductiva, metabólica y
negativo en fecundidad dada la pobre respuesta
psicológica (7).
a estimulación ovárica y a la fertilización in vitro
(IVF) (23).
La grasa corporal ejerce un papel como
reguladora en la reproducción. Grandes
El impacto del IMC en fertilidad se respalda
cantidades de células grasas producen grandes
con estudios que evidencian que la pérdida de
cantidades de estrógenos, lo cual ejerce un
peso puede tener un efecto positivo al propiciar
efecto anticonceptivo. No obstante, la falta de
un cambio en la función ovulatoria, además de
tejido adiposo provoca un déficit de estrógenos,
mejorar el estado metabólico (9,19).
lo cual interrumpe el ciclo menstrual y la
ovulación (21).
Un estudio transversal prospectivo evaluó a 103
pacientes jóvenes con delgadez u obesidad
Aproximadamente un 40-60% de las pacientes
desde la infancia, quienes se sometieron a
portadoras de SOP presentan obesidad (6,9),
análisis clínicos y hormonales completos. Se
la cual forma parte del síndrome metabólico
estudió su función menstrual, la prevalencia
característico de este padecimiento. Un 27.2%
de trastornos reproductivos y las correlaciones
de las pacientes portadoras de SOP asocian un
de los cambios hormonales respectivos
síndrome metabólico que cursa con obesidad
con el IMC. Se estableció que el IMC se
central, resistencia a la insulina y dislipidemia
correlaciona negativamente con la FSH y la
(8,22,23)
globulina transportadora de hormonas sexuales
(SHBG) y se correlaciona positivamente con la
Estudios evidencian que la severidad del
testosterona libre (TL) y testosterona total (TT).
hirsutismo y de la disfunción menstrual
correlaciona directamente con el grado de
Se obtuvo que el SOP y el síndrome metabólico
resistencia a la insulina (9). Adicionalmente, la
fueron los padecimientos más frecuentes
hiperinsulinemia contribuye a la desregulación
en mujeres con sobrepeso y obesidad, con
de la LH, e incrementa la producción de
evidencia que sugiere que la obesidad infantil
andrógenos, la anovulación y el riesgo
contribuye al desarrollo del SOP adolescente.
metabólico
(6,9).
Pacientes con SOP y
síndrome metabólico tienen una elevada
La HSC-NC y la disfunción ovárica prevalecieron
lipólisis en el fluido folicular, altos niveles de
en mujeres con bajo peso. Por otro lado, el IMC
colesterol y triglicéridos, con una disminución
también se ha relacionado con el aumento del
de lipoproteínas de alta densidad (HDL, por sus
riesgo de abortos espontáneos, tanto en mujeres
201
Revista Ciencia & Salud: Integrando Conocimientos / Agosto - Setiembre 2020 / Volumen 4 / Número 4
Integrando Conocimientos
con bajo peso como en mujeres con sobrepeso
Para el cribado de HSC-NC se utiliza un corte
u obesas (21).
basal de 17 OHP de 2ng/ml (6 nmol/l), menos
de este valor el diagnóstico de HSC-NC es poco
Diagnóstico diferencial de SOP e HSC-NC
probable (15).
en el contexto de infertilidad
El diagnóstico de la HSC-NC se basa en el
Para la realización de un diagnóstico certero
hallazgo de concentraciones séricas de 17-OHP
que permita la toma de decisiones terapéuticas
superiores a 10 ng/ml (30 nmol/L) en condiciones
adecuadas para la fertilidad de la paciente se
basales, temprano en la mañana durante la fase
deben tomar en cuenta desórdenes que simulan
folicular del ciclo menstrual, o después de la
estos padecimientos además de orientar el
estimulación con hormona adrenocorticotrópica
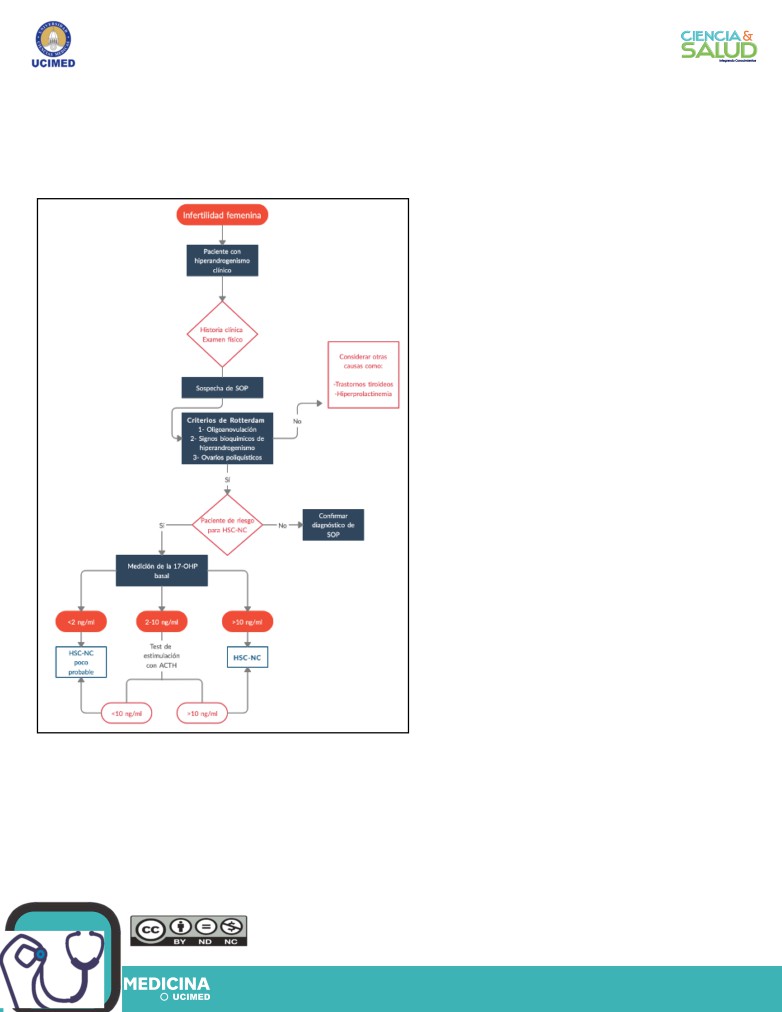
diagnóstico con exámenes de laboratorio (figura
(ACTH). La 17-OHP basal aumenta durante la
1).
fase lútea del ciclo menstrual.
La definición de PCOS ha sido ampliamente
Por lo tanto, la muestra debe obtenerse dentro
discutida por lo que se establecieron los
de los 10 primeros días después del comienzo
criterios de Rotterdam para la simplificación de
de la menstruación o en cualquier momento en
su diagnóstico.
que la paciente esté en amenorrea (5). Cuando
se obtiene un aumento del resultado basal de
La medición de hormonas circulantes en SOP
17-OHP inferior a 10 ng/ml debe confirmarse
tiene tres propósitos principales, demostrar el
mediante el hallazgo de 17-OHP por encima de
hiperandrogenismo, confirmar y demostrar la
10 ng/ml después de la estimulación con 250
disfunción ovárica y excluir desórdenes similares
mcg de ACTH. (5,15).
(9),
principalmente los trastornos tiroideos,
hiperprolactinemia e HSC-NC, mediante
Debido a que alrededor del 20% de las pacientes
la medición de la hormona estimulante de
con SOP poseen valores elevados de 17-OHP
tiroides, prolactina y la 17-hidroxiprogesterona,
(5), de estar disponible, se debe realizar la
respectivamente.
confirmación diagnóstica con el genotipo del
CYP21A2. Asimismo, respuestas normales de
Asimismo, el Colegio Americano de Ginecólogos
17-OHP basales y estimuladas por ACTH no
y Obstetras
(ACOG) recomienda el cribado
excluyen un estado portador para mutaciones
de la HSC-NC con 17-hidroxiprogesterona en
(15).
aquellas mujeres con elevado riesgo para esta,
dado que el diagnóstico temprano y tratamiento
corticosteroide podría mejorar el perfil
reproductivo. Sin embargo, todas las mujeres con
signos claros de hiperandrogenismo, síntomas y
quejas, independientemente del grado, deben
ser estudiadas por esta condición (9).
202
Revista Ciencia & Salud: Integrando Conocimientos / Agosto - Setiembre 2020 / Volumen 4 / Número 4
Integrando Conocimientos
SOP aun no se ha confirmado; mientras que en
Figura 1. Algoritmo para el diagnóstico diferencial
la HSC-NC se ha demostrado que la elevación
de infertilidad femenina. Fuente: Elaboración propia
androgénica produce alteraciones del eje HHO
con base en las referencias (5,15).
e interfiere con los pulsos de la GnRH. Otros
factores hormonales se han vinculado con
una foliculogénesis anormal, en el caso del
SOP debido a una hiperrespuesta a la FSH y
una respuesta inapropiada a LH; y en cuanto
a la HSC-NC, producto de una secreción
preferencial de LH y los niveles elevados de
estrógenos y progesterona.
El SOP se ha relacionado con alteraciones
anatómicas uterinas, en contraposición con
la HSC-NC, que no cursa con anormalidades
genitales intra útero. Ambos síndromes
pueden cursar con una morfología de ovario
poliquístico por lo que este hallazgo no es
útil para realizar una diferenciación certera.
Asimismo, en ambas patologías el IMC
desempeña un papel como regulador en la
reproducción, relacionado con una disfunción
esteroidogénica de los óvulos y la asociación
con hiperinsulinemia.
Se recomienda el uso de técnicas auxiliares
de laboratorio para sustentar el diagnóstico
entre estos entes. Al sospechar de HSC-NC
se utiliza un corte basal de 17 OHP durante
los 10 primeros días después del comienzo de
la menstruación o al presentarse amenorrea
en la paciente. El corte basal de esta prueba
Conclusiones
se estandarizó en 2ng/ml, un valor menor a este
convierte el diagnóstico de HSC-NC en poco
El diagnóstico diferencial
entre
el
SOP y la
probable.
HSC-NC exige una comprensión amplia
de los mecanismos fisiopatológicos que
los caracterizan. El rol de los andrógenos
adrenales como causantes de infertilidad en el
203
Revista Ciencia & Salud: Integrando Conocimientos / Agosto - Setiembre 2020 / Volumen 4 / Número 4
Integrando Conocimientos
BILBIOGRAFÍA
1.
Vander Borght M, Wyns C. Fertility and infertility: Definition and epidemiology. Clin Biochem.
2018;62(February):2-10.
2.
DeCherney, A., Olivares Bari, S. and Padilla Sierra, G., 2014. Diagnóstico Y Tratamiento Gine-
coobstétricos. 11th ed. México: McGrawHill Education, pp.879-889.
3.
Costello MF, Misso ML, Wong J, Hart R, Rombauts L, Melder A, et al. The treatment of infertility in
polycystic ovary syndrome: A brief update. Aust New Zeal J Obstet Gynaecol. 2012;52(4):400-3.
4.
Hanson B, Johnstone E, Dorais J, Silver B, Peterson CM, Hotaling J. Female infertility, in-
fertility-associated diagnoses, and comorbidities: a review. J Assist Reprod Genet [Internet].
5.
Papadakis G, Kandaraki EA, Tseniklidi E, Papalou O, Diamanti-Kandarakis E. Polycystic ovary
syndrome and NC-CAH: Distinct characteristics and common findings. A systematic review.
Front Endocrinol (Lausanne). 2019;10(JUN).
6.
Hachey LM, Kroger-Jarvis M, Pavlik-Maus T, Leach R. Clinical Implications of Polycystic Ovary
Syndrome in Adolescents. Nurs Womens Health [Internet]. 2020;24(2):115-26. Available from:
7.
Balen AH, Morley LC, Misso M, Franks S, Legro RS, Wijeyaratne CN, et al. The management of
anovulatory infertility in women with polycystic ovary syndrome: An analysis of the evidence to
support the development of global WHO guidance. Hum Reprod Update. 2016;22(6):687-708.
8.
Dennett CC, Simon J. The role of polycystic ovary syndrome in reproductive and metabolic heal-
th: Overview and approaches for treatment. Diabetes Spectr. 2015;28(2):116-20.
9.
Azziz R. Reproductive endocrinology and infertility: Clinical expert series polycystic ovary syn-
drome. Obstet Gynecol. 2018;132(2):321-36.
10. Joham AE, Teede HJ, Ranasinha S, Zoungas S, Boyle J. Prevalence of infertility and use of fer-
tility treatment in women with polycystic ovary syndrome: Data from a large community-based
cohort study. J Women’s Heal. 2015;24(4):299-307.
11.
Pereira N, Lin-su K. Reproductive Function and Fertility in Women with Congenital Adrenal
Hyperplasia. 2018;(August):101-7.
Ayalon-Dangur I, Segev-Becker A, Ayalon I, Eyal O, Israel S, Weintrob N. The many faces of
12.
non-classic congenital adrenal hyperplasia. Vol. 19, Israel Medical Association Journal. 2017.
p. 317-22.
204
Revista Ciencia & Salud: Integrando Conocimientos / Agosto - Setiembre 2020 / Volumen 4 / Número 4
Integrando Conocimientos
New MI, Ghizzoni L, Meyer-Bahlburg H, Khattab A, Reichman D, Rosenwaks Z. Fertility in pa-
13.
tients with nonclassical congenital adrenal hyperplasia. Fertil Steril [Internet]. 2019;111(1):13-
Livadas S, Bothou C. Management of the female with non-classical congenital adrenal hyper-
14.
plasia (NCCAH): A patient-oriented approach. Front Endocrinol (Lausanne). 2019;10(JUN):1-
11.
Carmina E, Dewailly D, Escobar-Morreale HF, Kelestimur F, Moran C, Oberfield S, et al. Non-clas-
15.
sic congenital adrenal hyperplasia due to 21-hydroxylase deficiency revisited: An update with a
special focus on adolescent and adult women. Hum Reprod Update. 2017;23(5):580-99.
Saleh HA, Shawky Moiety FM. Polycystic ovarian syndrome and congenital uterine anomalies:
16.
The hidden common player. Arch Gynecol Obstet. 2014;290(2):355-60.
Melo AS, Ferriani RA, Navarro PA. Treatment of infertility in women with polycystic ovary syn-
17.
drome: Approach to clinical practice. Clinics. 2015;70(11):765-9.
18.
Lekarev O, Lin-Su K, Vogiatzi M. Infertility and Reproductive Function in Patients with Con-
genital Adrenal Hyperplasia. Endocrinology and Metabolism Clinics of North America.
2015;44(4):705-722.
19.
Carmina E. Reproductive System Outcome Among Patients with Polycystic Ovarian Syndro-
me. Endocrinol Metab Clin North Am. 2015;44(4):787-97.
20.
Bongrani, A., Mellouk, N., Rame, C., Cornuau, M., Guérif, F., Froment, P. and Dupont, J., 2019.
Ovarian Expression of Adipokines in Polycystic Ovary Syndrome: A Role for Chemerin, Omen-
tin, and Apelin in Follicular Growth Arrest and Ovulatory Dysfunction?. International Journal of
Molecular Sciences, 20(15), p.3778.
Kristesashvili J, Chikvaidze N, Gegechkori M. Types of reproductive disorders in underweight
21.
and overweight young females and correlations of respective hormonal changes with BMI. Vol.
36, Giornale Italiano di Ostetricia e Ginecologia. 2014. p. 521-3.
22.
Huang-Doran I, Franks S. Genetic Rodent Models of Obesity-Associated Ovarian Dysfunc-
tion and Subfertility: Insights into Polycystic Ovary Syndrome. Front Endocrinol (Lausanne).
2016;7(June).
He Y, Lu Y, Zhu Q, Wang Y, Lindheim SR, Qi J, et al. Influence of metabolic syndrome on fema-
23.
le fertility and in vitro fertilization outcomes in PCOS women. Am J Obstet Gynecol [Internet].
205