Revista Ciencia & Salud: Integrando Conocimientos / Agosto - Setiembre 2020 / Volumen 4 / Número 4
Integrando Conocimientos
Glioblastomas: clasificación, caracterización
molecular y vías de señalización comúnmente
alteradas
Glioblastomas: classification, molecular characterization
and commonly altered signaling pathways
Pág. 106, 115
Recibido: 09-06-2020
Aceptado: 25-06-2020
Dra. María Catalina Camacho Alvarado1
Dra. Daniela Taboada Mora2
1,2. Médico Cirujano General, trabajador independiente. San José,Costa Rica.
RESUMEN
ABSTRACT:
El Glioblastoma Multiforme (GBM) es la neoplasia
Glioblastoma Multiforme
(GBM) is the most
primaria maligna del Sistema Nervioso Central
frequent primary malignant neoplasm of the
(SNC) más frecuente a nivel mundial. Este tiene
Central Nervous System (CNS) worldwide. It
una de las tasas de supervivencia más bajas de
has one of the lowest survival rates of any brain
cualquier tumor cerebral a pesar de avances en
tumor despite advances in diagnostic techniques,
técnicas diagnósticas, mayor entendimiento de
greater understanding of its tumor genesis and
su génesis tumoral y la existencia de terapias
the existence of targeted therapies. The 2016
dirigidas. Se modifica la Clasificación de
World Health Organization (WHO) CNS Tumor
Tumores del SNC de la Organización Mundial de
Classification is modified due to the relevance
la Salud (OMS) de 2016 debido a la relevancia
of including molecular parameters in addition
de incluir parámetros moleculares además de
to the classic histological characterization for
la caracterización histológica clásica para su
diagnosis, the main altered signaling pathways
diagnóstico, las principales vías de señalización
and the methyl-guanine methyl transferase
alteradas y el biomarcador Metil-guanina metil-
(MGMT) biomarker.
transferasa (MGMT).
106
Revista Ciencia & Salud: Integrando Conocimientos / Agosto - Setiembre 2020 / Volumen 4 / Número 4
Integrando Conocimientos
PALABRAS CLAVE
El GBM tiene una edad promedio de aparición
de 64 años, siendo poco común en niños. La
Glioblastoma, neoplasias del sistema nervioso
incidencia es 1.6 veces mayor en hombres que
central, clasificación, transducción de señal,
en mujeres y 2.0 veces mayor en caucásicos en
biomarcadores.
comparación con africanos y afroamericanos,
con menor incidencia en asiáticos e indios
KEYWORDS
americanos(4).
Glioblastoma,
central
nervous system
Costa Rica presentó una de incidencia de 1,3
neoplasms, classification, signal transduction,
por cada 100,000 habitantes para 2015, según
biomarkers.
datos oficiales del Ministerio de Salud. En
promedio, entre el 2011 y el 2015, se reportaron
INTRODUCCIÓN
51 casos por año entre todos los grupos etarios.
El Glioblastoma Multiforme
(GBM) es el
tumor primario maligno del Sistema Nervioso
La mayor incidencia se presenta en la población
Central (SNC) más frecuente a nivel mundial.
adulta, comportamiento similar al establecido
Corresponde al 14% de todos los tumores de
en estadísticas internacionales. Sin embargo,
SNC y al 48% de todos los tumores malignos de
no se cuenta con datos nacionales oficiales de
SNC. Estos últimos con una incidencia estimada
la sub-clasificación de los GBM, de acuerdo
en 7.08 por cada 100.000 habitantes según
con los criterios moleculares establecidos por la
estadísticas del Registro Central de Tumores
Organización Mundial de la Salud (OMS)(5).
Cerebrales de los Estados Unidos (CBTRUS,
por sus siglas en inglés)(1)(Tabla 1).
El GBM se describe clásicamente como un tumor
de origen glial, de características infiltrativas,
La heterogeneidad de sus componentes, así
con nucleación atípica, alta actividad mitótica,
como su alta resistencia a tratamiento lo colocan
proliferación vascular extensa y presencia de
entre las neoplasias más agresivas y de peor
pronóstico(2). La mediana de supervivencia
necrosis(6). Por lo general, tiene una localización
posterior al diagnóstico es de 12 meses y la
supratentorial, con alguna incidencia a nivel
tasa de supervivencia a 5 años es de 6.8%(1),
cerebelar. Su presentación clínica depende
contribuyendo de manera desproporcional a la
de la localización anatómica, así como de sus
mortalidad y morbilidad por cáncer(3).
características histológicas y moleculares.(7).
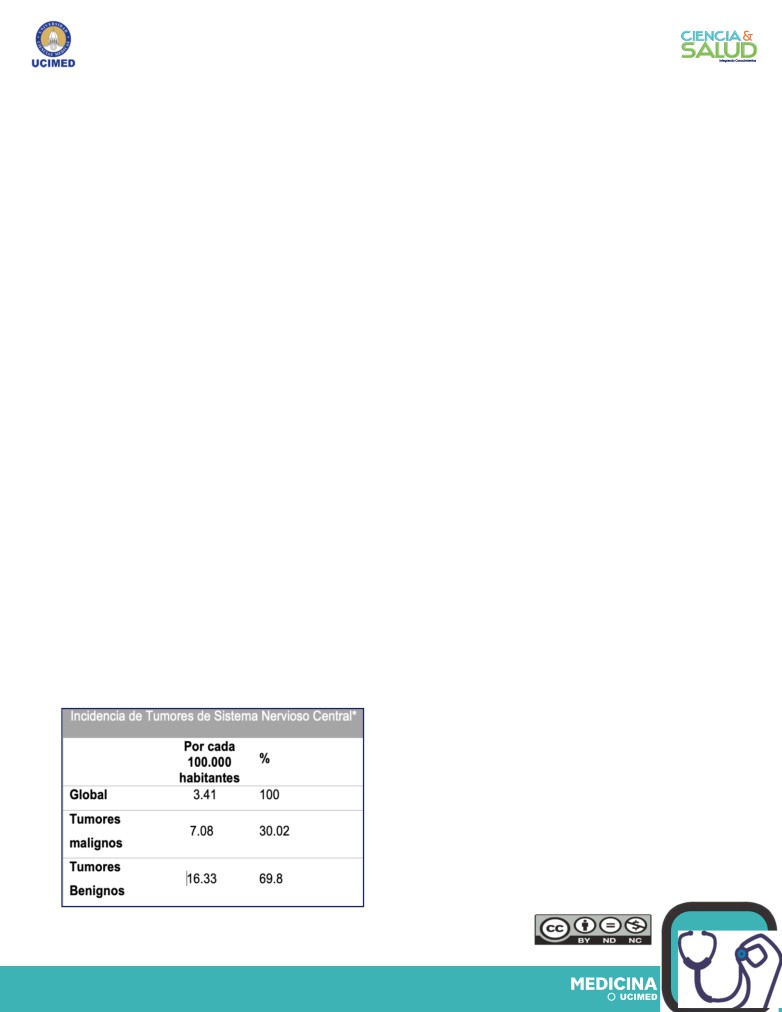
Tabla 1. Incidencia de
tumores malignos y benignos
de Sistema Nervioso Central
según datos del CBTRUS(1).
* Ajustada por edad.
107
Revista Ciencia & Salud: Integrando Conocimientos / Agosto - Setiembre 2020 / Volumen 4 / Número 4
Integrando Conocimientos
diagnósticos, sino que fueron utilizadas como
marcadores de proliferación celular y determi-
nantes de comportamiento biológico(9). En la
última clasificación de Tumores de SNC de la
OMS publicada en 2016, se integran por prime-
ra vez criterios moleculares, cambio de particu-
lar relevancia para la definición del GBM(2).
A pesar de la integración histo-molecular para
el diagnóstico del GBM y comprenderse de una
manera más amplia las vías de señalización
comúnmente alteradas, existen pocos cambios
significativos en el abodaje médico-quirúrgico
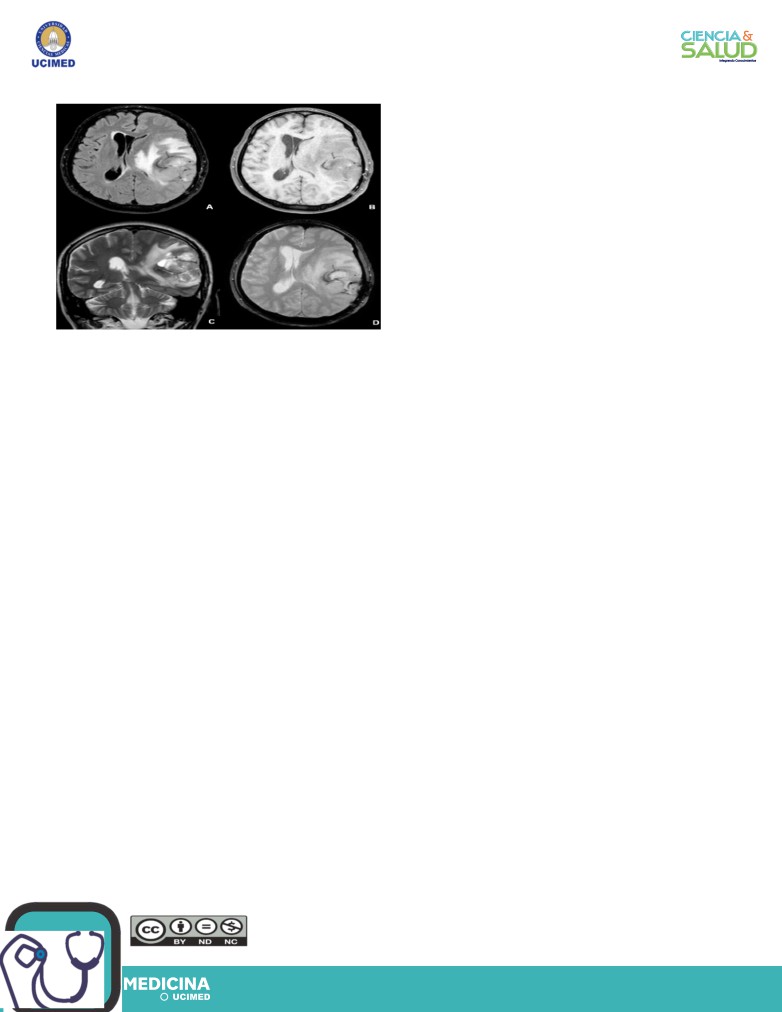
Imagen 1. Imagen de Resonancia Magnética de
en las últimas dos décadas. El estándar de tra-
GBM, lesión tumoral parietal izquierda. A y B. Cortes
tamiento implica resección tumoral máxima se-
axiales en Flair y T1 sin contraste, respectivamente.
guida de radioterapia, además de quimioterapia
Lesión intraparenquimatosa heterogénea con efec-
con Temozolomida(TMZ)(10), régimen estable-
to de masa, edema perilesional (flechas amarillas
en A), desviación de línea media y compresión de
cido en el ensayo clínico de 2004 EORTC-NCIC.
ventrículos laterales (flecha negra en imagen B). C.
Si bien este protocolo es el de mayor sustento
Corte Coronal en T2. Herniación subfalcial leve (fle-
científico hasta el momento, la heterogeneidad
cha blanca). D. Corte axial en T2. Edema perilesio-
molecular y mecanismos de resistencia celular
nal (flecha amarilla). Cortesía del Centro Nacional
del GBM requieren de fármacos que superen su
de Resonancia Magnética (CNRM).
complejidad(3).
DESARROLLO
Según la Clasificación de Tumores de SNC de
la OMS realizada en 2007, el GBM se definió
La Clasificación de Tumores del Sistema Ner-
como una entidad de origen astrocítico, Grado
vioso Central de la Organización Mundial de la
IV, con dos variantes: el GBM de células gigan-
Salud, edición 2016, incluye por primera vez
tes y el Gliosarcoma. Desde entonces, se vin-
parámetros moleculares además de la carac-
culan algunas alteraciones genéticas comunes
terización histológica clásica. Previamente, las
en la génesis tumoral del GBM, tales como am-
similitudes tumorales establecidas dependían
plificación del receptor del factor de crecimien-
únicamente del análisis microscópico bajo tin-
to epidérmico (EGFR por sus siglas en inglés,
ción de hematoxilina/eosina, expresión inmuno-
también conocido como HER1), supresión ho-
histoquímica y rasgos ultraestructurales. Esta
mocigota del gen p16INK4a, y mutaciones gen
clasificación se planteó a partir de las guías de
PTEN y pérdida de la heterocigosidad en el cro-
incorporación de hallazgos moleculares en el
mosoma 10q(8).
diagnóstico de tumores cerebrales, establecidas
por la Sociedad de Neuropatología en 2014(2).
Si bien se reconocían estas características mo-
leculares en los GBM, no constituyeron criterios
108
Revista Ciencia & Salud: Integrando Conocimientos / Agosto - Setiembre 2020 / Volumen 4 / Número 4
Integrando Conocimientos
son IDH silvestres, tumores primarios y obser-
vados con mayor frecuencia en pacientes ma-
A
yores de 55 años. Cerca del 10% de los casos
presentan mutación en la IDH, típicamente se-
cundarios a gliomas IDH-mutados de menor
grado y característicos de población adulta jo-
ven(6). La mutación en la IDH es una de las
primeras alteraciones genéticas detectables y
principales precursoras de la génesis tumoral
de los gliomas(11).
B
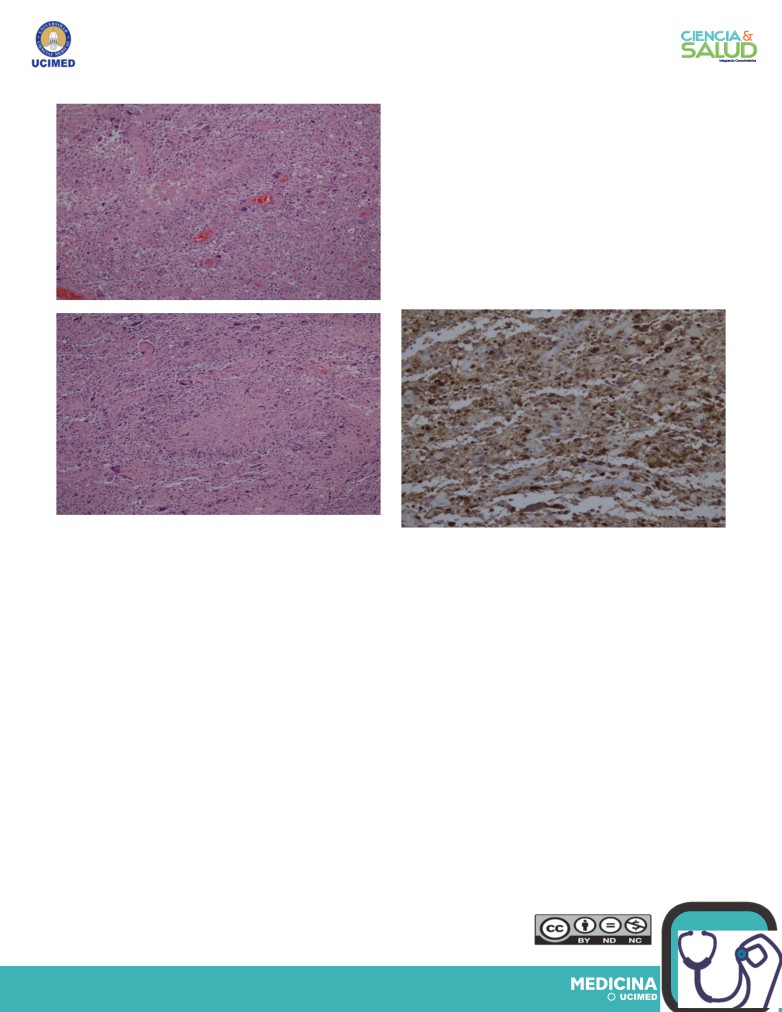
Imagen 2. Cortes histológicos de GBM. A y B. Se
observa aumento de la celularidad y presencia
Imagen 3. GBM IDH-1 positivo, inmunohistoquímica.
de importante pleomorfismo celular, necrosis en
Cortesía Servicio de Anatomía Patológica, Hospital
empalizada y proliferación microvascular. Cortesía
México.
Servicio de Anatomía Patológica, Hospital México.
Existen distintos perfiles genéticos que culmi-
En la actualización realizada se definen enti-
nan en la expresión anómala de la enzima IDH.
dades nuevas, subclasificación o variantes y
Por lo general los astrocitomas difusos o ana-
algunos patrones histológicos reconocibles sin
plásicos IDH-mutados y los GBM IDH-mutados
mayor significancia clínico-patológica. Se in-
secundarios a ellos, tienen vías de génesis tu-
corporan así el GBM isocitrato-deshidrogena-
moral comunes. Asimismo, presentan un com-
sa (IDH) silvestre o “wild-type” y el GBM isoci-
portamiento biológico similar y mutaciones en
trato-deshidrogenasa mutado, en ausencia de
los genes ATRX y TP53. Por otro lado, el GBM
codeleción en regiones 1p/19q. Se asigna adi-
IDH-salvaje presenta alteraciones en tres vías
cionalmente una categoría NOS, “no otherwise
principales, descritas más adelante.
specified” por sus siglas en inglés, para los tu-
mores no tipificables y aquellos casos donde no
En términos fisiológicos, la IDH es conocida por
se cuente con pruebas moleculares(2).
su rol en el ciclo de Krebs como catalizadora
de la descarboxilación oxidativa del isocitrato,
Aproximadamente el 90% de los glioblastomas
resultando en alfa-cetoglutarato y dióxido de
109
Revista Ciencia & Salud: Integrando Conocimientos / Agosto - Setiembre 2020 / Volumen 4 / Número 4
Integrando Conocimientos
carbono. Las isoformas IDH1 e IDH2 codifican
pérdidas en el cromosoma 10(6).
proteínas citosólicas y mitocontriales, respecti-
vamente(6). Ambas isoformas tienen un papel
La variante GBM de células pequeñas se ca-
primordial en el metabolismo celular, regulación
racteriza por células gliales monofórmicas(15),
epigenética, estados Redox y de reparación del
mientras que el Gliosarcoma presenta compo-
ácido desoxirribonucleico (ADN)(12).
nentes gliales y mesenquimales. Radiológica y
clínicamente estas variables son indistinguibles
Mutaciones puntuales en IDH1 e IDH2 ocasio-
y se requiere diagnóstico histopatológico. Los
nan sustitución de arginina a histidina o a lisi-
patrones corresponden a: GBM de células pe-
na, respectivamente. Dicha sustitución altera
queñas, GBM de células granulares y de com-
la actividad catalítica de manera que producen
ponente neural primitivo.
niveles altos del oncometabolito 2-hidroxigluta-
rato (2-HG) en lugar de alfa-cetoglutarato(13).
Desde el punto de vista clínico, se hace referen-
El 2-HG funciona como un inhibidor competitivo
cia al origen primario y secundario, sin embargo,
de la alfa-cetoglutarato, deteriorando la función
quedan en desuso como criterios diagnósticos.
de dioxigenasas-alfa-cetoglutarato dependien-
El uso de marcadores moleculares genera un
tes como las histonas y las ADN-desmetilasas
reordenamiento de las familias tumorales y se
(enzimas TET). Esto conduce a alteraciones de
conoce de previo que algunas entidades serán
metilación del ADN a lo largo del genoma(14).
descartadas conforme se avance en técnicas
biomoleculares. Esta actualización no incluye
Las mutaciones en la IDH1 e IDH2 en los ca-
una técnica específica para el diagnóstico mo-
sos de GBM del adulto predicen una supervi-
lecular y lo deja a criterio médico y a disponibili-
vencia mayor en comparación con los GBM tipo
dad del centro involucrado.
silvestre(10). A su vez, la alteración enzimática
de ambas isoformas se asocia a un periodo li-
I. VÍAS DE SEÑALIZACIÓN ALTERADAS EN
bre de enfermedad más prolongado y una mejor
GBM
respuesta a quimioterapia con TMZ(6).
Datos de The Cancer Genome Atlas (TCGA)
También se agrega en 2016 el GBM tipo epite-
muestran alteraciones en 3 vías centrales de
lioide, que junto con el GBM de células gigantes
señalización específicas:
y el gliosarcoma, forman parte de la subclasifi-
cación del subtipo silvestre. La variante epite-
II. VÍA P14ARF-MDM2-MDM4-P53
lioide presenta células grandes con citoplasma
eosinofílico y nucléolos prominentes, que se
La proteína p53, codificada en el gen TP53 en
asemejan a las células del melanoma, y células
el cromosoma 17p13.1 tiene un rol fundamen-
rabdoides. Es más frecuente en niños y adultos
tal en la supresión tumoral. En respuesta a
jóvenes portando una mutación en el gen BRAF
señales de estrés como daño del ADN, el p53
V600E. Usualmente carecen de otras caracte-
induce reparación de ADN, arresto del ciclo ce-
rísticas típicas del GBM tipo silvestre, como mu-
lular y apoptosis celular. Un 86% de los GBM
taciones en el receptor del factor de crecimiento
tiene desregulación de la vía p53 por mutación
epidérmico (EGFR por sus siglas en inglés) y
o deleción del gen TP53 (28%), amplificación
110
Revista Ciencia & Salud: Integrando Conocimientos / Agosto - Setiembre 2020 / Volumen 4 / Número 4
Integrando Conocimientos
MDM2/4 (15%) reguladores negativos de p53
y/o deleción o mutación de CDKN2A (58% ex-
Las translocaciones comunes fusionan porciones
presa p14ARF, regulador negativo de MDM2/4)
de EGFR a otros asociados genéticos, siendo
(16). Las alteraciones de TP53 son mutualmen-
EGFR-SEPT14 (septin
14) la fusión génica
te excluyentes con cambios MDM2/4 y son más
funcional más común. Estas alteraciones son
comunes en glioblastomas secundarios que en
altamente sugestivas de GBM, especialmente
primarios (68% vs 28%). La pérdida de p14ARF
en pacientes mayores. A pesar de ello, no hay
no muestra predilección por ningún subtipo de
evidencia suficiente para utilizar la amplificación
GBM(20).
de EGFR o la mutación EGFRvIII como
pronóstico para pacientes con GBM.
No se conoce bien la implicación pronóstica de
la mutación de p53 en GBM, principalmente por
El gen del PDGFRA se localiza en el
la diversidad de mutaciones que estos presen-
cromosoma 4q12 y codifica un RTK similar al
tan. En gliomas IHD mutados se encuentra fre-
EGFR también vinculado en la proliferación del
cuentemente la mutación de p53 y se asocia a
GBM. Este receptor de superficie se encuentra
un mejor pronóstico. Por el contrario, los glio-
mutado en un 30% de los GBM, con múltiples
blastomas primarios no se suele encontrar la
reordenamientos reconocidos. La isoforma del
mutación y conllevan un peor pronóstico(6).
receptor P PDGFRA8,9 (deleción de exones
8 Y
9) es frecuente resulta en activación
III. VÍA RTK-RAS-PI3K
constitutiva. La fusión génica entre el receptor
del dominio de inserción de quinasa (KDR) y
Varios receptores de superficie de tirosina qui-
el gen PDGFRA muestra una actividad tirosina
nasa (RTKs), como el receptor de crecimiento
quinasa aumentada constitutivamente.
epidérmico (EGFR) y el receptor de factor de
crecimiento derivado de plaquetas A (PDGFRA),
También se presenta la amplificación del PD-
se encuentran sobreexpresados en gliomas de
GFRA y muestra una reducción importante en
alto grado y muestran distintas alteraciones en
la sobrevida media, solamente en el subgrupo
los subtipos de GBM clásico y proneural.
IDH1 mutado. Si bien se reconoce la importan-
cia del PDGFR en la proliferación del GBM, tam-
El gen del EGFR selocaliza en el cromosoma 7p12
poco se reconoce su significancia pronóstica.
y codifica un RTK que promueve la proliferación
celular que tiene efecto en las vías MAPK y
MET es un proto-oncogen inducido por hipoxia
PI3K. Un 50% de los GBM primarios tienen
y un receptor de superficie de tirosina quinasa
sobreexpresión del EGFR por amplificación de
para el factor de crecimiento del hepatocito.
su gen correspondiente, alteración mutuamente
Es común su amplificación en GBM y estudios
excluyente con codeleción 1p/19q y mutaciones
genómicos de a nivel de células individuales
en el gen de la IDH. Los reordenamientos del
mostraron que una pequeña fracción de célu-
gen EGFR, que comúnmente involucran la
las de glioblastomas tiene amplificación focal
variante EGFRvIII con una sobrexpresión en el
de c-MET(21). Múltiples procesos celulares
marco de los exones 2 a 7, dan como resultado la
en los gliomas se encuentran regulados por el
activación de vías de señalización mitogénicas.
MET, tales como su proliferación, supervivencia
111
Revista Ciencia & Salud: Integrando Conocimientos / Agosto - Setiembre 2020 / Volumen 4 / Número 4
Integrando Conocimientos
y migración. La sobreexpresión de MET en los
líticas y reguladoras distintas, respectivamente,
GBM se asocia a mal pronóstico y mayor inva-
como parte de la vía PI3K / AKT / mTOR. Esta
sividad(22).
cascada de señalización es activada por RTK
como EGFR y es inhibida por PTEN(25).
El homólogo de la fosfatasa y tensina (PTEN)
es un gen supresor tumoral ubicado en el cro-
Varios miembros de esta vía, incluidos RTK,
mosoma 10q23, codifica una proteína que actúa
PI3K, AKT y mTOR, son los blancos princiapa-
como regulador negativo de la vía de señaliza-
les para la inhibición farmacológica En los glio-
ción PI3K/AKT/objetivo mamífero de la rapami-
blastomas, la activación de la vía PI3K / AKT /
cina (mTOR). Es común encontrar mutaciones o
mTOR está asociada con la resistencia a la qui-
deleciones en el PTEN en glioblastomas prima-
mioterapia con TMZ(26). La activación de esta
rios del adulto(17).
vía se ha asociado con una supervivencia global
significativamente menor en pacientes con glio-
La pérdida de heterocigosidad (LOH, por sus
blastoma(6).
siglas en inglés) en el cromosoma 10 es la al-
teración cromosómica más frecuente en los
El estudio de estas vías da luz a la complejidad
glioblastomas primarios, observándose en un
de la tumorogenesis del GBM. Al mismo tiempo,
80%. La deleción en el locus PTEN es de las
permite el establecimiento de marcadores
regiones del cromosoma 10 más comúnmente
pronósticos y de resistencia a tratamiento
eliminados(23). La pérdida de la expresión de
y la elaboración de terapias dirigidas. Entre
PTEN por IHC no confiere independientemente
los biomarcadores más prometedores se
un peor pronóstico en los casos de glioblastoma
encuetra el de la enzima metil-guanina metil-
recién diagnosticados tratados con temozolomi-
transferasa
(MGMT). La metiltransferasa de
da (TMZ). Por el contrario, LOH del cromosoma
ADN ha demostrado tener valor predictivo en
10 es predictivo de una supervivencia más cor-
pacientes con GBM considerados candidatos
ta(24).
para tratamiento con TMZ(10).
Por FISH se puede identificar fácilmente las
El mecanismo de acción de la TMZ implica la
aberraciones citogenéticas en PTEN, incluidas
metilación de la posición O6 de la guanina, lo
las deleciones homocigóticas y hemizigotas,
que conduce a un desajuste de ADN y rupturas
así como la pérdida total del cromosoma 10. Al-
de doble cadena, que consecuentemente
ternativamente, se pueden utilizar métodos ba-
culmina en la muerte de las células afectadas.
sados en PCR. La evaluación de la pérdida de
Cuando la enzima MGMT está activa, evita esta
PTEN por parte de IHC aún no es confiable(17).
cascada al eliminar el grupo metilo de la guanina
La fosfatidilinositol-4,5-bisfosfato
3-quinasa
O6. La metilación del promotor MGMT da como
representa una familia de proteínas con una
resultado una disminución de la actividad
amplia variedad de funciones, que incluyen el
enzimática de MGMT, lo que conduce a una
crecimiento celular, la supervivencia y la diferen-
reparación disminuida del desajuste de ADN y
ciación. Esta familia PI3K se subdivide en varias
una mayor sensibilidad a TMZ(27).
clases de proteínas. Las proteínas de clase I,
como PIK3CA y PIK3R1, tienen funciones cata-
Múltiples ensayos clínicos en fase III han
112
Revista Ciencia & Salud: Integrando Conocimientos / Agosto - Setiembre 2020 / Volumen 4 / Número 4
Integrando Conocimientos
evidenciado que la metilación del promotor
Previo a la integración molecular-histológica
MGMT confiere una supervivencia más larga de
para la clasificación de neoplasias del sistema
hasta un 50% en pacientes con GBM tratados con
nervioso central, algunos tumores eran
clasificados como gliomas de bajo grado a
TMZ. Por el contario, en ausencia de metilación
pesar de guardar características moleculares
del MGMT, existe poca o ninguna respuesta
comunes con el GMB. Al determinarse que
a la quimioterapia con TMZ. Esto podría ser
tumores originarios de glía tienen alteraciones
suficiente para la exclusión de esta terapia, no
en las vías de señalización comunes para GBM,
obstante, los estudios aún se encuentran en
múltiples estudios sustentan que tendrán un
curso, al igual que otras opciones de terapia-
comportamiento similar, así como una misma
génica dirigida.(10)
respuesta al tratamiento.
La metilación del promotor MGMT es común en
Es necesario implementar la clasificación
los glioblastomas adultos (40%) y se observa
establecida por la OMS en 2016 de manera
con frecuencia en gliomas IDH mutados / CIMP-
exhaustiva para optimizar el abordaje, tratamiento
alto. Dicha metilación del promotor MGMT rara
y mejorar el pronóstico de los pacientes. Para
vez se ve en tumores pediátricos. La interacción
tal efecto, podrían implementarse, además de
entre el estado de metilación del promotor
los integrados como criterios, biomarcadores
MGMT y TMZ es compleja y puede verse
como el MGMT para determinar el estado de
afectada por otros factores. Por ejemplo, se
metilación del GBM y así predecir la resistencia
han sugerido mutaciones o expresión alterada
la Temozolomida, evitando la supradosificación
en las proteínas de reparación de anomalías
y quimiotoxicidad para los pacientes. Toda
(MMR) (MSH2, MSH6, MLH1, PMS2) como
atención debe dirigirse a mejorar su calidad
mecanismos alternativos de resistencia a
de vida, especialmente en el contexto de esta
TMZ. Además, diferentes modalidades de
neoplasia de pronóstico exiguo a corto plazo.
prueba de MGMT, incluyendo IHC, PCR y la
pirosecuenciación han arrojado diversos niveles
de correlación con el resultado clínico(6).
CONCLUSIÓN
El GBM es la neoplasia maligna primaria del
Sistema Nervioso Central más frecuentemente
diagnosticada en Costa Rica y el mundo. Si bien
su incidencia es relativamente baja, contribuye
de manera desproporcional a la morbimortalidad
por cáncer. La expectativa de vida a 5 años, el
periodo libre de enfermedad y el estándar de
tratamiento continúan sin cambios significativos
a pesar de los avances moleculares y en terapia
dirigida. Existe gran cantidad de literatura
y ensayos clínicos en curso que presentan
terapias prometedoras, sin suficiente sustento
para su implementación como terapia estándar.
113
Revista Ciencia & Salud: Integrando Conocimientos / Agosto - Setiembre 2020 / Volumen 4 / Número 4
Integrando Conocimientos
BIBLIOGRAFÍA
1.
Ostrom QT, Cioffi G, Gittleman H, Patil N, Waite K, Kruchko C, et al. CBTRUS Statistical Report:
Primary Brain and Other Central Nervous System Tumors Diagnosed in the United States in
2012-2016. Neuro-Oncol. 1 de noviembre de 2019;21(Supplement_5):v1-100.
2.
Louis DN, Perry A, Reifenberger G, von Deimling A, Figarella-Branger D, Cavenee WK, et al.
The 2016 World Health Organization Classification of Tumors of the Central Nervous System:
a summary. Acta Neuropathol (Berl). junio de 2016;131(6):803-20.
3.
Zanders ED, Svensson F, Bailey DS. Therapy for glioblastoma: is it working? Drug Discov
Today. mayo de 2019;24(5):1193-201.
4.
Department of Neurosurgery, Jordan University Hospital and Medical School, University
of Jordan, Amman, Jordan, Tamimi AF, Juweid M, Department of Radiology and Nuclear
Medicine, Jordan University Hospital and Medical School, University of Jordan, Amman, Jordan.
Epidemiology and Outcome of Glioblastoma. En: Department of Neurosurgery, University
Hospitals Leuven, Leuven, Belgium, De Vleeschouwer S, editores. Glioblastoma [Internet].
Codon Publications; 2017.
5.
Registro Nacional de Tumores. Incidencia de Glioblastomas Según Grupos de Edad por Sexo
y Año de Ocurrencia (cifras absolutas), Costa Rica, 2011-2015. Ministerio de Salud de Costa
Rica;
6.
Brem S, Abdullah KG. Glioblastoma [Internet]. 2017 [citado 1 de diciembre de 2019]. Disponible
7.
Schwartz SI, Brunicardi FC, Andersen DK. Principios de cirugía [de] Schwartz. México: McGraw-
Hill Interamericana; 2015.
8.
Louis DN, Ohgaki H, Wiestler OD, Cavenee WK, Burger PC, Jouvet A, et al. The 2007 WHO
Classification of Tumours of the Central Nervous System. Acta Neuropathol (Berl). 12 de julio
de 2007;114(2):97-109.
9.
Komori T. The 2016 WHO Classification of Tumours of the Central Nervous System: The Major
Points of Revision. Neurol Med Chir (Tokyo). 2017;57(7):301-11.
10.
Wen PY, Weller M, Lee EQ, Alexander BA, Barnholtz-Sloan JS, Barthel FP, et al. Glioblastoma
in Adults: A Society for Neuro-Oncology (SNO) and European Society of Neuro-Oncology
(EANO) Consensus Review on Current Management and Future Directions. Neuro-Oncol. 24
de abril de 2020;noaa106.
114
Revista Ciencia & Salud: Integrando Conocimientos / Agosto - Setiembre 2020 / Volumen 4 / Número 4
Integrando Conocimientos
11.
Liu Y-Q, Wu F, Li J-J, Li Y-F, Liu X, Wang Z, et al. Gene Expression Profiling Stratifies IDH-
Wildtype Glioblastoma With Distinct Prognoses. Front Oncol. 17 de diciembre de 2019;9:1433.
12.
Molenaar RJ, Maciejewski JP, Wilmink JW, van Noorden CJF. Wild-type and mutated IDH1/2
enzymes and therapy responses. Oncogene. abril de 2018;37(15):1949-60.
13.
Aldape K, Zadeh G, Mansouri S, Reifenberger G, von Deimling A. Glioblastoma: pathology,
molecular mechanisms and markers. Acta Neuropathol (Berl). junio de 2015;129(6):829-48.
14.
Malta TM, de Souza CF, Sabedot TS, Silva TC, Mosella MS, Kalkanis SN, et al. Glioma CpG
island methylator phenotype (G-CIMP): biological and clinical implications. Neuro-Oncol. 9 de
abril de 2018;20(5):608-20.
15.
Takeuchi H, Kitai R, Hosoda T, Yamada S, Hashimoto N, Kikuta K, et al. Clinicopathologic
features of small cell glioblastomas. J Neurooncol. abril de 2016;127(2):337-44.
16.
Brennan CW, Verhaak RGW, McKenna A, Campos B, Noushmehr H, Salama SR, et al. The
Somatic Genomic Landscape of Glioblastoma. Cell. octubre de 2013;155(2):462-77.
17.
Pekmezci M, Perry A. Practical Molecular Pathologic Diagnosis of Infiltrating Gliomas. Surg
Pathol Clin. marzo de 2015;8(1):49-61.
18.
Purkait S, Jha P, Sharma MC, Suri V, Sharma M, Kale SS, et al. CDKN2A deletion in pediatric
versus adult glioblastomas and predictive value of p16 immunohistochemistry: CDKN2A/p16 in
glioblastomas. Neuropathology. agosto de 2013;33(4):405-12.
19.
Goldhoff P, Clarke J, Smirnov I, Berger MS, Prados MD, James CD, et al. Clinical Stratification
of Glioblastoma Based on Alterations in Retinoblastoma Tumor Suppressor Protein (RB1) and
Association With the Proneural Subtype. J Neuropathol Exp Neurol. enero de 2012;71(1):83-9.
20.
The Cancer Genome Atlas Research Network. Comprehensive genomic characterization defines
human glioblastoma genes and core pathways. Nature. octubre de 2008;455(7216):1061-8.
Trusolino L, Bertotti A, Comoglio PM. MET signalling: principles and functions in development,
21.
organ regeneration and cancer. Nat Rev Mol Cell Biol. diciembre de 2010;11(12):834-48.
22.
Kong D-S, Song S-Y, Kim D-H, Joo KM, Yoo J-S, Koh JS, et al. Prognostic significance of
c-Met expression in glioblastomas: c-Met Expression in Glioblastomas. Cancer. 1 de enero de
2009;115(1):140-8.
23.
Ohgaki H. Genetic pathways to glioblastomas. Neuropathology. marzo de 2005;25(1):1-7.
115
Revista Ciencia & Salud: Integrando Conocimientos / Agosto - Setiembre 2020 / Volumen 4 / Número 4
Integrando Conocimientos
24. Carico C, Nuño M, Mukherjee D, Elramsisy A, Dantis J, Hu J, et al. Loss of PTEN Is Not
Associated with Poor Survival in Newly Diagnosed Glioblastoma Patients of the Temozolomide
Era. Lo AWI, editor. PLoS ONE. 29 de marzo de 2012;7(3):e33684.
25. Li X, Wu C, Chen N, Gu H, Yen A, Cao L, et al. PI3K/Akt/mTOR signaling pathway and targeted
therapy for glioblastoma. Oncotarget [Internet]. 31 de mayo de 2016 [citado 3 de diciembre de
26. Stupp R, Mason WP, van den Bent MJ, Weller M, Fisher B, Taphoorn MJB, et al. Radiotherapy
plus Concomitant and Adjuvant Temozolomide for Glioblastoma. N Engl J Med. 10 de marzo
de 2005;352(10):987-96.
27. Jiang H, Zeng W, Ren X, Cui Y, Li M, Yang K, et al. Super-early initiation of temozolomide
prolongs the survival of glioblastoma patients without gross-total resection: a retrospective
cohort study. J Neurooncol. agosto de 2019;144(1):127-35.
116