Hepatitis autoinmune: manifestacines, diagnóstico y
tratamiento.
Autoimmune Hepatitis: manifestations, diagnosis and
treatment.
Sofia Rojas Diaz 1 Carolina Jiménez Martínez2 Viviana Saenz Ramírez 3 Kimberly Arias Amador 4
1 y 2Médico general trabajador independiente, San José, Costa Rica 3 Médico general.Trabajador
independiente, Heredia Costa Rica 4 Médico generalTrabajador independiente, Cartago Costa Rica.
Contacto: rojasdiazso@hotmail.com
RESUMEN
La hepatitis autoinmune tiene distribución global, puede afectar a pacientes de am-
bos géneros y de todas las edades. La incidencia de hepatitis autoinmune varía se-
gún grupos étnicos y se ha asociado con predisposición genética, ocurre tras la
exposición de antígenos y algunos factores que afectan la presentación de autoan-
tígenos, la activación de inmunocitos y proliferación de células efectoras. Se han su-
gerido como desencadenantes algunos virus, bacterias y medicamentos. La clínica
puede variar desde un cuadro asintomático hasta una hepatitis crónica o fulminante.
El diagnóstico está basado en la exclusión de otras enfermedades hepáticas, la de-
tección de manifestaciones clínicas y bioquímicas, aumento de inmunoglobulinas,
presencia de autoanticuerpos e histología compatible (infiltrado de células plasmáti-
cas en la zona peri-portal, presencia de células gigantes multinucleadas, necrosis en
la interfase, infiltrado lobular con necrosis focal). Se clasifica en dos tipos con base
Cómo citar:
Rojas Diaz, S., Jimé-
en los auto-anticuerpos séricos presentes. La base del tratamiento es la administra-
nez Martínez , C. .,
ción de esteroides, principalmente prednisona; y el objetivo es alcanzar la remisión,
Saenz Ramírez, V. .,
resolución histológica y bioquímica y la desaparición de los síntomas clínicos.
& Arias Amador, K.
Hepatitis autoinmu-
Palabras clave: Hepatitis autoinmune, ictericia, hepatitis crónica.
ne: manifestacines,
diagnóstico y tra-
tamiento. Revista
Ciencia Y Salud, 5(3),
org/10.34192/cien-
ciaysalud.v5i3.288
15/ene/2021
17/mar/2021
22/jun/2021
6
6
ABSTRACT
Autoimmune hepatitis has a global distribution; it can affect patients of both se-
xes and all ages. The incidence of autoimmune hepatitis varies according to ethnic
groups and has been associated with genetic predisposition, occurs after exposure
of antigens or other factors that affect the presentation of autoantigens, activation
of immunocytes and proliferation of effector cells. Some viruses, bacteria and medi-
cations have been suggested as triggers. The clinic can vary from an asymptomatic
condition to chronic or fulminant hepatitis. The diagnosis is based on the exclusion
of other liver diseases, the detection of clinical and biochemical manifestations, in-
creased immunoglobulins, presence of autoantibodies and compatible histology (in-
filtrated plasma cells in the periportal area, presence of multinucleated giant cells,
necrosis at the interface, lobular infiltrate with focal necrosis). It is classified into two
types based on the serum autoantibodies present. The basis of treatment is the ad-
ministration of steroids, mainly prednisone; and the objective is to achieve remission,
histological and biochemical resolution and the disappearance of clinical symptoms.
Keywords: Autoimmune hepatitis, jaundice, chronic hepatitis.
INTRODUCCIÓN
En 1955 Waldeström Joske describió por primera vez la hepatitis autoinmune como “hepatitis viral crónica”,
al observar un tipo de hepatitis crónica que se presentaba principalmente en mujeres jóvenes y que asocia-
ba infiltración de células plasmáticas en el hígado, alteraciones dermatológicas, amenorrea e hipergammag-
lobulinemia. Joske describió, en 1955 la presencia de anticuerpos antinucleares en hepatitis crónicas activas
y en 1956, MacKay la denominó hepatitis lupoide, de forma errónea ya que no está relacionada con el lupus.
En 1966, Whittingham demostró la asociación con anticuerpos anti-músculo liso, denominándola hepatitis
crónica activa autoinmune (1).
Actualmente, la hepatitis autoinmune se considera una enfermedad inflamatoria y necrótica del hígado, la
cual es crónica, progresiva, infrecuente y de etiología desconocida. Se caracteriza por alteraciones inmuno-
lógicas como la presencia de autoanticuerpos, hipergammaglobulinemia y buena respuesta al tratamiento
inmunosupresor (1). A nivel patológico, se presenta con inflamación portal a lo largo del parénquima hepá-
tico e infiltración linfoplasmocitaria. Se cree que esta enfermedad ocurre en pacientes que están genética-
mente predispuestos posterior a la exposición de un factor desencadenante, como una infección. El daño
autoinmune se da por alteración de la función de los linfocitos T regulares, a través de mimetismo molecular
contra un antígeno presente en la superficie de los hepatocitos. Esto produce inflamación, necrosis y fibro-
sis en el hígado (2).
La presentación clínica suele ser insidiosa y con síntomas generales, poco específicos, como náusea, fatiga,
ictericia, dolor abdominal y artralgias; aunque podría presentarse también como una hepatitis aguda severa
(2).
EPIDEMIOLOGIA
La hepatitis autoinmune tiene distribución global, puede afectar a pacientes de ambos géneros y de todas
las edades, pero ocurre predominantemente en mujeres. En Suecia, el 76% de los casos ocurre en mujeres
y en Estados Unidos la proporción de presentación de mujeres: hombres es 3,5:1. La edad de presentación
en los hombres suele ser más temprana, con pico en la adolescencia; por el contrario, el pico de incidencia
en la población femenina se da tras la menopausia. En los Estados Unidos, la hepatitis autoinmune afecta
100 000 a 200 000 personas y corresponde la causa de trasplante en el 4-6% de los trasplantes en adultos
7
y 2-3% en la población pediátrica (2).
La incidencia de hepatitis autoinmune varía según grupos étnicos y se ha asociado con predisposición ge-
nética. La prevalencia es mayor en pacientes caucásicos de la zona norte de Europa y en América del Norte,
quienes usualmente presentan HLA-DRB1 (2).
En el año 2008, Jing Ngu et al, realizaron un estudio en Nueva Zelanda que incluyó a 494 170 (equivalen-
tes al 12% de la población del país) se determinó hepatitis autoinmune en 123 pacientes. De los pacientes
positivos para hepatitis autoinmune, el 96% era caucásicos, 71% era mujeres, y 72% tenía más de 40 años,
concluyendo que la incidencia era mayor en mujeres de raza blanca mayores de 60 años (3).
FISIOPATOLOGIA
Previamente se creía que la HAI tenía una etiología viral en la cual los anticuerpos producidos por el cuer-
po contra el virus producían un daño hepático. Posteriormente, se creía que posterior a un daño hepático
causado por cualquier etiología, se producía una liberación de antígenos hepáticos que desencadenaba una
respuesta inmune continua produciendo necrosis hepatocelular (4).
Actualmente se considera que la hepatitis autoinmune ocurre en pacientes con predisposición genética,
tras exposición de antígenos y algunos factores que afectan la presentación de autoantígenos, la activación
de inmunocitos y proliferación de células efectoras. Las variantes genéticas y los polimorfismos aumen-
tan o disminuyen el riesgo de la enfermedad; sin embargo, poseer una mutación potencial que causa la
enfermedad no significa que la enfermedad se vaya a manifestar. Algunos agentes como toxinas, virus y
medicamentos se han sugerido como desencadenantes de la hepatitis autoinmune. Se considera que exis-
te mimetismo molecular y actividad cruzada entre epítopos virales, medicamentos y antígenos hepáticos.
Los desencadenantes podrían actuar varias veces antes de activar la hepatitis autoinmune; por este motivo
podrían pasar muchos años desde que se empieza a desarrollar la enfermedad hasta que se manifieste.
Actualmente se sabe que algunos virus (hepatitis A, hepatitis C, hepatitis E, sarampión, Epstein-Barr y el
virus herpes simple), y algunos medicamentos (nitrofurantoína, melatonina, diclofenaco, propiltiouracilo y
las estatinas) se asocian a hepatitis autoinmune (2, 5).
En un paciente sano, el equilibrio entre los linfocitos T reguladores específicos de antígeno hepático (CD4,
CD25, FOXP3) y las células efectoras que comparten la especificidad por las mismas regiones auto antigé-
nicas, resulta en tolerancia. Si se deterioran las células T o si las células efectoras responden mal al control,
se pierde la tolerancia a los autoantígenos hepáticos, lo que lleva al inicio y progreso del daño hepático
autoinmune. Aún no está claro si el colapso de la tolerancia inmune a los autoantígenos se debe solamente
a una disminución en el número de linfocitos T reguladores funcionales o si también hay alteración en la
capacidad de respuesta de los linfocitos efectores (6).
A pesar de que se ha descrito y se ha establecido asociación de autoanticuerpos en no órgano específicos
como los anticuerpos antinucleares y los anti-músculo liso en los pacientes con hepatitis autoinmune, no
se sabe la función exacta de estos anticuerpos en la patología de la enfermedad. Desde un punto de vista
práctico, la hepatitis autoinmune se divide en dos subtipos de acuerdo con los anticuerpos presentes. La
hepatitis autoinmune tipo 1 se asocia a anticuerpos antinucleares o a anticuerpos anti-músculo liso y el 58%
de los pacientes con hepatitis tipo 1 presenta anticuerpos anti-antigeno soluble hepático o pancreático. La
Hepatitis autoinmune tipo 2 se asocia a anticuerpos anti-LMK 1 o anti-citosol hepático. Los anti-LMK1 están
dirigidos hacia varios epítopos de citocromos hepáticos, principalmente el CYP2D6; se ha demostrado re-
actividad cruzada entre varios virus, incluida la del virus de Hepatitis C. Esto sugiere que los virus pueden
simularse entre sí y por reactividad cruzada con el epítopo CYP2D6 generar hepatitis autoinmune. El re-
ceptor de asiaglicoproteína es un autoantígeno capaz de iniciar la hepatitis autoinmune y presenta especi-
ficidad por la membrana del hepatocito; se han identificado anticuerpos hacia este receptor en pacientes
con hepatitis autoinmune (6).
8
Los linfocitos T reguladores de la interacción hepatocito-autoantígeno se han descrito en pacientes con
hepatitis autoinmune tipo 2 y actúan como guardianes de la respuesta inmune al controlar la proliferación
y secreción de citoquinas inflamatorias como la interleucina 17 y el interferón. Se cree que también que
controlan a las células B, porque se ha observado una relación inversa entre el número de células T regula-
doras y los niveles de autoanticuerpos, como el anticuerpo microsomal anti-hígado y riñón de tipo 1, en la
hepatitis autoinmune tipo 2 y como el anticuerpo anti-antígeno soluble hepático en la hepatitis autoinmune
tipo 1. Si las células T reguladoras no ejercen control adecuado, las células efectoras no se revisan adecua-
damente, los monocitos y macrófagos se reclutan y producen aumento de los niveles de citoquinas pro-
inflamatorias. Los linfocitos natural killer también se reclutan en el sitio de daño hepático y brindan ayuda
a los linfocitos CD8 efectores. En ratones y humanos también se han visto implicadas en la patología de la
hepatitis autoinmune las células Th17, las cuales secretan interleucina 17. Además, estos pacientes presentan
un número aumentado de linfocitos T γ δ; y la expresión de la molécula efectora granzima B correlaciona
directamente con los niveles de alanina aminotransferasa y de bilirrubina, que son marcadores de daño he-
pático. La expresión inducida de las moléculas de antígeno leucocitario humano clase II en los hepatocitos
hace que estas células puedan actuar como presentadoras de antígeno y contribuir a la perpetuación del
daño hepático (6).
Los genes del complejo mayor de histocompatibilidad tienen un rol en la hepatitis autoinmune, principal-
mente aquellos genes que codifican moléculas HLA, las cuales son cruciales para la generación de la res-
puesta inmune y la respuesta de los linfocitos T. El surco de unión peptídica de la molécula del complejo de
histocompatibilidad mayor (MCH) tipo II está codificado por alelos que determinan la capacidad de activar
inmunocitos. Los alelos que se han relacionado con una mayor suceptibilidad de hepatitis autoinmune en
personas caucásicas en Europa y Norte América son DRB1*0301 and DRB1*0401, la secuencia que compar-
ten está formada por 6 aminoácidos LLEQKR y se encuentra entre las posiciones 67 y 72 de la cadena de
polipéptidos DRβ de la molécula de MCH de clase II. La lisina “K” en la posición 71 es el determinante más
importante de la susceptibilidad. Por otra parte, los alelos DRB1*0404 y DRB1*0405 son los alelos suscep-
tibles en pacientes mexicanos, japoneses, chinos y argentinos; codifican una secuencia similar a la antes
mencionada, con la excepción de que presenta una Arginina en la posición 71 y no una lisina. La arginina
es un aminoácido que es similar en estructura a la lisina, por lo que la substitución de lisina-arginina no va-
ría de forma importante las propiedades de la molécula del MCH clase II. La cadena de 6 aminoácidos del
MHC limita la cantidad de péptidos que se pueden acomodar; sin embargo, hay múltiples autoantígenos o
antígenos externos que pueden cumplir los requisitos estructurales y servir de péptidos inmunológicos (6).
Otro alelo asociado con hepatitis autoinmune es el DRB1*1301 en población de Sur América, este alelo codi-
fica para ILEDER en las posiciones 67-72. La variación de la susceptibilidad a la hepatitis autoinmune en las
diferentes regiones y grupos étnicos puede deberse a factores de las poblaciones indígenas nativas de cada
zona. En Sur América, DRB1*1301 se asocia a infección por el virus Hepatitis A, y las personas con este alelo
presentan una exposición prolongada al virus que puede favorecer el desarrollo de la hepatitis autoinmune
(2).
Los promotores genéticos, tanto dentro como fuera del MHC tienen la capacidad de afectar la aparición
de enfermedades y el fenotipo clínico, en sinergia con los alelos de susceptibilidad o en lugar de estos. El
alelo DRB1*0401 produce una enfermedad menos severa, con menos relapsos y con presentación a edad
más avanzada. Los polimorfismos del gen TNF-α, del promotor del gen Fas en la posición 670 y el gen del
antígeno 4 de linfocitos T citotóxicos se han asociado a un aumento de la reactividad inmune, la gravedad
de la hepatitis autoinmune y de la rápida progresión a cirrosis en pacientes caucásicos (6).
La destrucción de las células hepáticas se logra por citotoxicidad mediada por células y por citotoxicidad
dependiente de anticuerpos. La primera depende de la expansión clonal de células T CD8 que causan lesión
en los hepatocitos mediante la liberación de linfocinas, este mecanismo está regulado por las citocinas tipo
1. La segunda, dependiente de anticuerpos, está regulada por las citocinas tipo 2, las células T natural killer
9
logran la destrucción de los hepatocitos al unir su receptor Fc con un complejo antígeno-anticuerpo en la
superficie del hepatocito. El mecanismo citotóxico predominante depende de la diferenciación fenotípica
de la célula T CD4. (2)
Los defectos en el medio de las citocinas contrarreguladoras también pueden reflejar un número de células
T natural killer intrahepáticas reducido y una falla de los linfocitos T reguladores (CD4 y CD25) para mo-
dular la proliferación de linfocitos CD8 y la producción de citoquinas. El reclutamiento y el tránsito intra-
hepático de los linfocitos T citotóxicos puede aumentarse mediante la regulación positiva de quimiocinas
como CXCL16 y las células estrelladas hepáticas pueden transformarse en miofibroblastos por actividad
inflamatoria, lo que estimula la fibrogénesis. Las proteínas de la matriz se acumulan en el hígado y retardan
las acciones degradativas de las metaloproteinasas a medida que las células estrelladas se continúan acti-
vando de manera autocrina al trasformar el factor de crecimiento β. Las perturbaciones en los mecanismos
de contra regulación que influyen en la citotoxicidad, la respuesta inflamatoria y la apoptosis de las células
efectoras y diana son la base de la aparición y la gravedad de la hepatitis autoinmune. La incertidumbre
sobre el rol de las células T reguladoras en la patogénesis de la hepatitis autoinmune es un claro ejemplo
de que aún se requiere estudiar la fisiopatología de la enfermedad para mejorar el diseño de las futuras
terapias. La apoptosis es el principal mecanismo de la muerte de las células hepáticas y las características
histológicas son consecuencia de la apoptosis hiperactiva medida por el receptor, a través de interacciones
de ligando Fas-Fas. (2)
MANIFESTACIONES CLÍNICAS
La hepatitis autoinmune puede presentarse de diferentes maneras con un patrón fluctuante ya sea desde
un cuadro asintomático, una hepatitis crónica o como un cuadro agudo de hepatitis. La clínica se caracte-
riza por reflejar un patrón inflamatorio a nivel hepático y es poco frecuente que se presente con un patrón
colestásico (2).
Es importante un diagnóstico temprano para prevenir la progresión del daño hepático. La presentación
aguda de la enfermedad se da en un 30-40% de los casos, sin embargo, la presentación como una hepatitis
crónica es más frecuente (2).
El inicio del cuadro suele relacionarse con sintomatología inespecífica pero frecuentemente asociada a he-
patopatías de etiologías distintas. Se pueden encontrar pacientes con un examen físico normal con estudios
de laboratorio alterados y diagnosticados de manera incidental (7).
Los síntomas más comunes son la astenia, adinamia, anorexia, náuseas, dolor abdominal en hipocondrio
derecho, artralgias, prurito. Lesiones a nivel de piel se dan en un 8-17% de los casos con una picazón macu-
lopapular inespecífico en cara, brazos y tronco. Al examen físico se puede encontrar hepatomegalia en un
76% de los casos, esplenomegalia y telangiectasias (6).
En estados avanzados de la enfermedad se puede asociar una clínica de hipertensión portal como ascitis,
encefalopatía hepática y un sangrado por varices esofágicas (8).
Un 14-44% de los pacientes presenta enfermedades autoinmunes extrahepáticas asociadas; sin embargo,
se relaciona con pacientes de 60 años o más. Algunas de estas enfermedades son la tiroiditis autoinmune,
enfermedad de Graves y Artritis Reumatoides. También se asocian otras enfermedades dermatológicas
como la psoriasis, vitíligo, eritema nodoso y liquen plano (2).
DIAGNÓSTICO
El diagnóstico de las hepatitis autoinmunes está basado en la exclusión de otras enfermedades hepáticas, la
detección de manifestaciones clínicas y bioquímicas, aumento de inmunoglobulinas, presencia de autoan-
ticuerpos e histología compatible. No existe un marcador patognomónico de la hepatitis autoinmune (2).
Bioquímica y pruebas de función hepática
10
La hepatitis autoinmune generalmente presenta un patrón de citólisis reflejado con el aumento de las tran-
saminasas. Un aumento de la bilirrubina, la gammaglutamil transferasa y fosfatasa alcalina debe dirigir a
descartar otras hepatopatías antes de pensar en una Hepatitis autoinmune (8).
La AST, ALT séricas y gamma globulina reflejan la severidad de la enfermedad y ayudan a dar un pronóstico
inicial. Pacientes con casos de HAI severa sin tratamiento con niveles de AST 10 veces el límite superior,
niveles de ALT séricos 5 veces el límite superior y niveles de gamma globulina 2 veces el límite superior,
tienen una mortalidad del 40% a 6 meses (2).
En los casos de presentación aguda, las transaminasas (alanino aminotransferasa ALT y aspartato amino-
transferasa AST) pueden presentar un aumento de 10 a 20 veces con respecto al límite superior normal y
tener una relación de fosfatasa alcalina (FA) y AST menor a 1:5, mientras que en los pacientes con síntomas
crónicos los niveles de transaminasas no se ven tan aumentados y la relación FA y AST es cercana a 1:2 (6).
En la electroforesis de proteínas se evidencia un aumento de gammaglobulinas por aumento de la IgG pro-
ducto de la proliferación policlonal de linfocitos B.
Las concentraciones de IgG pueden ser mayores a 1.5 de su límite superior normal, mientras que las IgA e
IgM se mantienen en rangos normales. El nivel de inmunoglobulinas se puede utilizar para dar seguimiento
a la enfermedad y valorar una adecuada respuesta al tratamiento (8,9).
Autoanticuerpos
La presencia de autoanticuerpos se considera pilar importante para el diagnóstico; sin embargo, la ausencia
de los mismo no descarta el diagnóstico.
Entre los principales o más frecuentes se encuentran anticuerpo antinuclear (ANA), anticuerpo contra el an-
tígeno de la musculatura lisa (AML), anticuerpo contra las microsomas hepatorrenales (anti-LKM), anticuer-
po contra el antígeno citosólico hepático 1 (anti-LC-1) y anticuerpo contra los antígenos hepáticos solubles
(anti-SLA/LP). Estos anticuerpos no son específicos de la hepatitis autoinmune, sin embargo el anti-SLA/
LP presenta el valor predictivo más alto por su alta especificidad (99%) y se ha asociado a un cuadro más
severo con mayor probabilidad de recaída al suspender el tratamiento. El 80% de los adultos con HAI se
les detecta el ANA y el 63% presenta AML, no obstante solo un 3% se asocia con la presencia de anti-LKM1
(8,10).
Los estudios de autoanticuerpos se realizan principalmente por medio de inmunofluorescencia (IFT), sin
embargo, también se ha utilizado ELISA, Western Blot, Radio inmunoensayo. Los niveles de autoanticuer-
pos 1:40 en adultos y 1:20 en niños se consideran significativamente elevados (7).
Los niveles de anticuerpos no se utilizan para dar seguimiento a la enfermedad ya que no se sabe con cer-
teza que evidencien o varíen proporcionalmente a la respuesta terapéutica (7,11).
Existen dos tipos de HAI, dependiendo de los anticuerpos que estén presentes:
-
Tipo 1: presenta anticuerpos con ANA y AML
-
Tipo 2: presenta anticuerpos anti -LKM1 usualmente en la ausencia de ANA y AML.
Sin embargo hasta un 20% de los casos de hepatitis autoinmune no presenta anticuerpo ANA, SMA ni anti-
LKM1, que se conoce como Hepatitis autoinmune seronegativa (10).
11
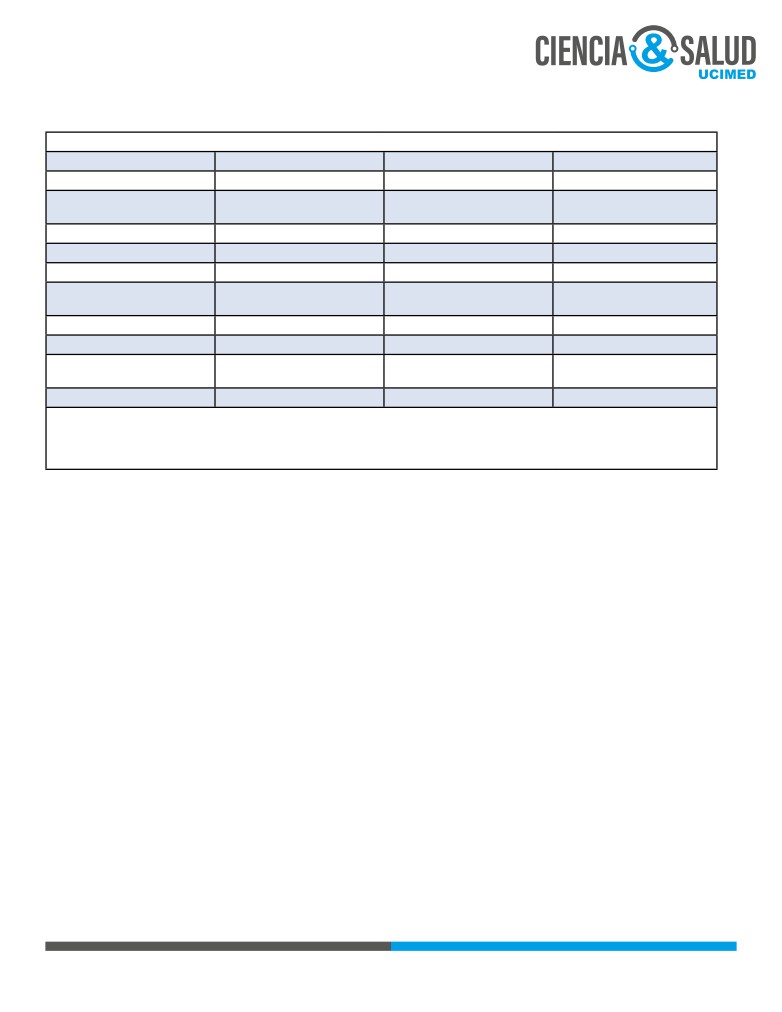
Tabla 1: Anticuerpos asociados a hepatitis autoinmune
Autoanticuerpos con sus principales características asociados a la Hepatitis Autoinmune
Autoanticuerpo
Localización Hepatocitaria
Enfermedad asociada
Subtipo de HAI
ANA
Nuclear
HAI/LES
1
ASMA
Citoplasma
HAI/ solapamiento HAI-
1
CBP
P- ancas
Citoplasma
HAI/ vasculitis/ CEP
1
Anti- SLA/LP
Citoplasma
HAI
1
Anti- LKM-1
R.E
HAI/HC
2
Anti- LKM-3
R.E
HAI/ asociada a hepatitis
2
C/D
Anti-LKM
R.E
HAI/ SPA_1/HC
2/SPA-1
Anti- LC1
Citoplasma
HAI/ HC?
2
Anti- M4
Membrana
externa
HAI
1
mitocondrial
Anti-R-ASGP
Membrana citoplasmática
HAI/CBP
1/2
R.E: retículo endoplásmico, HC: hepatitis C, SPA-1: Síndrome poliglandular autoinmune tipo 1.
Tomado de J. A. ORTS COSTA, A. ZÚÑIGA CABRERA1, I. ALARCÓN TORRES2. (2004). Hepatitis autoinmune. AN. MED. INTERNA
(Madrid), Vol. 21, N.o 7, pp. 340-354. J. A. ORTS COSTA, A. ZÚÑIGA CABRERA1, I. ALARCÓN TORRES2. (2004). Hepatitis autoin-
mune. AN. MED. INTERNA (Madrid), Vol. 21, N.o 7, pp. 340-354.
Histología
Una biopsia con cambios histopatológicos característicos de HAI es fundamental para realizar el diagnósti-
co (10). En la hepatitis autoinmune no existe un patrón histológico patognomónico, pero ayuda a determi-
nar la gravedad de la enfermedad. Es importante recalcar que el tipo de lesión asociado a HAI puede estar
presente en otras hepatopatías (8).
La hepatitis de interfase es el hallazgo característico de la HAI y es el lugar donde se encuentra una marcada
diferencia entre la zona inflamatoria y el parénquima hepático sano. Si además de este hallazgo se encuen-
tra el infiltrado de células plasmáticas, la biopsia puede guiar a un diagnóstico de hepatitis autoinmune (6).
Los hallazgos más característicos son: infiltrado de células plasmáticas en la zona peri-portal, presencia de
células gigantes multinucleadas, necrosis en la interfase, infiltrado lobular con necrosis focal y con menor
frecuencia, la aparición de rosetas de hepatocitos en el área peri-portal. Además, se evidencian cambios en
el conducto biliar como colangitis destructiva y no destructiva; y en casos moderados y severos, fibrosis
hepática. Frecuentemente se encuentra un fenómeno conocido como emperipolesis que se caracteriza por
la entrada de linfocitos y células plasmáticas intactas dentro de células epiteliales, en este caso hepatocitos
(7, 10).
La emeripolesis se encuentra en el 65% de los pacientes con HAI. El infiltrado de células plasmáticas se
visualiza hasta en un 66% de los pacientes y las rosetas de hepatocitos en un 33%. La biopsia se considera
uno de los pilares diagnósticos de la HAI, ya que permite identificar el grado de la enfermedad, valorar la
inflamación y la fibrosis hepática. (10). Ayuda a descartar diagnósticos diferenciales ya que hasta un 20%
de los pacientes puede presentar autoanticuerpos indetectables. La valoración histológica también puede
ser utilizada durante el tratamiento para valorar la evolución de la enfermedad (6).
En pacientes asintomáticos se recomienda realizar una biopsia antes de la suspensión del tratamiento para
valorar la presencia de inflamación o la presencia de cirrosis activa, ya que no se recomendaría el abandono
del tratamiento (7). El resultado de las biopsias puede ayudar a determinar el riesgo de recidivas valorando
12
la actividad inflamatoria. Ausencia de infiltrados inflamatorios se asocia únicamente a un 20% de recidivas,
sin embargo, si se evidencian infiltrados portales el riesgo de recidiva aumenta a un 50%. El 100% de reci-
diva se da en pacientes con actividad inflamatoria en la interfase (7).
Estudios de imagen
No hay hallazgos de imagen característicos para las hepatitis autoinmunes por lo que no se realizan de
rutina, excepto en casos pediátricos en los que se realiza una colangiopancreatografía por resonancia mag-
nética para excluir colangitis esclerosante (6,11).
Criterios diagnóstico
Algunos autores consideran criterios diagnósticos en los pacientes con clínica compatible asociado a una
biopsia positiva y respaldada por (5,10, 12):
-
Aumento de al menos una transaminasa (generalmente AST) o ALT al menos dos veces su valor
superior normal.
-
Al menos uno positivo: IgG aumentado, hipergammaglobulinemia, anticuerpos positivos (ANA, AML,
anti LKM, anti LC1, anti SLA/LP).
-
Descartar causas virales, farmacológicas, hereditarias, colestásicas y alcohólicas.
Los autoanticuerpos están presentes en un 90% de los casos, sin embargo, los únicos específicos para HAI
son los anticuerpos anti-SLA, positivos en 10-30% de los casos.
En adultos, la concentración de autoanticuerpos es muy variada durante la enfermedad y no tiene relación
con el grado de inflamación hepática, por lo que niveles bajos de autoanticuerpos no la descartan y en au-
sencia de otros hallazgos, niveles altos tampoco hacen un diagnóstico (7).
En casos pediátricos, los niveles de autoanticuerpos y la concentración de IgG sí se relacionan con la acti-
vidad de la enfermedad, por lo que se puede utilizar para monitorizar el tratamiento (7).
Actualmente, existe un sistema de puntuación simplificado para estandarizar el diagnóstico de HAI consi-
derado altamente específico. Sin embargo, no es confiable en casos pediátricos, pacientes colestásicos o
con hepatopatía grasa asociada (3,7).
Se incluyen cuatro parámetros: títulos de autoanticuerpos, niveles de IgG, criterios histológicos hepáticos y
la exclusión de una hepatitis viral, donde el diagnóstico probable se da con una puntación de 6 y se confir-
ma con una puntuación igual o mayor a 7. Existe un sistema de puntuación original que es más complejo,
donde se le asigna puntaje a la clínica, laboratorios e histología. Este sistema se puede aplicar tanto antes
o después de que el paciente recibió tratamiento (8).
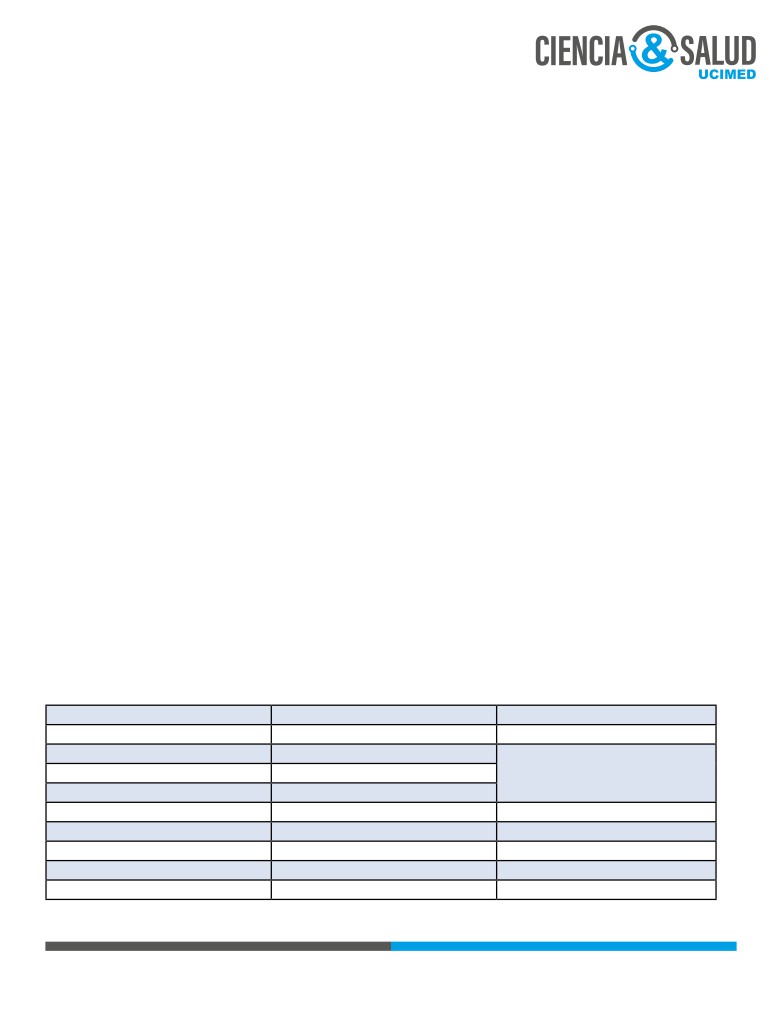
Tabla 2: Criterios simplificados para el diagnóstico de hepatitis autoinmune
Variable
Valor
Puntos
ANA o AML
>= 1:40
1
ANA o AML
>= 1:80
2
O anti LMK
>= 1:40
O anti ALS
Positivo
IgG
>Al límite superior normal
1
>1.1 límite superior normal
2
Histología
Compatible con HAI
1
HAI típica
2
Ausencia de hepatitis viral
Sí
2
13
>= 6 pts: HAI probable
>= 7 pts: HAI definitiva
Tomado de Morillas, R; Planas, R. (2012). Hepatitis Autoinmune. En Montoro, M; Pagán, J. Gastroenterología y Hepatología, Pro-
blemas comunes en la práctica clínica (pp.747 -758). España. Editorial Jarpyo, S.A.
CLASIFICACIÓN Y VARIANTES
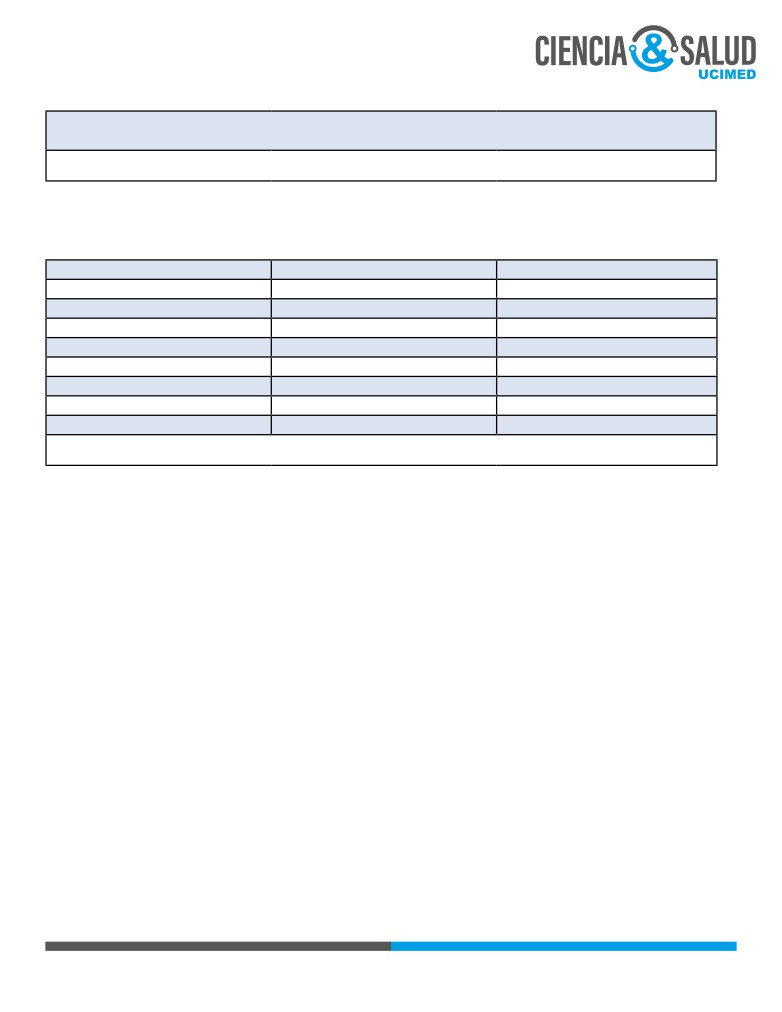
Las hepatitis autoinmunes se clasifican según el perfil serológico:
Tabla 3: Clasificación de las hepatitis autoinmunes
Tipo 1 (70-80%)
Tipo 2
Edad de presentación
Indefinida
Predominantemente jóvenes
Hombre: mujer
4:1
8:1
Niveles IgG
Altos
Variables
Niveles IgA
Normal
+/- IgA alta
Autoanticuerpos positivos
ANA, AML, AAA
LKM-1 +/- Anti ALC 1
Cirrosis a los 3 años
40%
80%
Fracaso del tratamiento
Infrecuente
Frecuente
Tratamiento a largo plazo
Variable
100%
Tomado de Morillas, R; Planas, R. (2012). Hepatitis Autoinmune. En Montoro, M; Pagán, J. Gastroenterología y Hepatología, Proble-
mas comunes en la práctica clínica (pp.747 -758). España. Editorial Jarpyo, S.A.
Cabe destacar que hasta un 20% de las hepatitis autoinmunes no presentan anticuerpos positivos; se de-
nomina HAI con anticuerpos negativos o hepatitis crónica criptogénica; y se diagnostica ante la buena res-
puesta a la terapia antiinflamatoria (6).
DIAGNÓSTICO DIFERENCIAL
La hepatitis autoinmune debe ser diferenciada de otras causas de hepatitis crónicas. Específicamente la
hepatitis causada por el Virus de Hepatitis C (VHC) la cual debe confirmarse con la detección de ARN ya
que muestra interacciones con el sistema autoimune con la presencia de anticuerpos frecuentemente en-
contrados en HAI. Se ha reportado hasta un 9-38% de ANA positivos y 5-91% de AML positivo. (J. A. Orts
Costa et al., 2004)
Otras causas de hepatitis crónica a excluir son la ingesta abundante de alcohol y de medicamentos que
pueden causar sintomatología y cambios histológicos de hepatitis crónica (J.A. Orts Costa et al., 2004).
En pacientes principalmente pediátricos se debe descartar Enfermedad de Wilson, que presenta además
concentraciones elevadas de cobre y ceruloplasmina. (Heneghan et al., 2013)
TRATAMIENTO
El objetivo del tratamiento es disminuir la sintomatología y controlar el proceso inflamatorio que está ocu-
rriendo en el hígado para lograr una remisión, prevenir que la fibrosis y la severidad de la enfermedad (14).
Existen criterios para valorar el requerimiento de tratamiento inmunosupresor (7,9):
Criterios absolutos:
-
Aumento de AST >10 veces por encima del valor normal
-
AST >5 veces el límite superior asociado a aumento de gammaglobulina 2 veces por encima del
límite superior de normalidad
-
Biopsia que demuestre cambios histológicos como necrosis en puente o necrosis de muchos acinos.
14
Criterios relativos
-
Sintomatología
-
AST <5 veces el valor normal
-
Gammaglobulina menor a dos veces el valor normal
-
Casos de hepatitis interfase
Todos los pacientes con HAI son candidatos a tratamiento de primera línea, excepto los que presenten una
enfermedad inactiva ya sea por clínica, por laboratorio o por hallazgos histológicos (14).
En pacientes pediátricos, se debe iniciar tratamiento inmediatamente posterior al diagnóstico, ya que su
evolución es más grave; inclusive un 50% de los casos presenta cirrosis en el momento del diagnóstico. La
única excepción es que el paciente presente cirrosis sin signos de actividad inflamatoria ya que el trata-
miento sería inefectivo (7).
Régimen de tratamiento
La base del tratamiento en las hepatitis autoinmunes es la administración de esteroides (principalmente
prednisona), la cual puede utilizarse a dosis inicial de 40-60 mg/d como monoterapia o a dosis de 20-40
mg/d, al asociarla con azatioprina (50- 150 mg/d). Ambas terapias son igualmente eficaces, pero se ha visto
preferencia a la combinada por reducción de los efectos adversos de los esteroides, principalmente con-
siderando los pacientes geriátricos, con osteoporosis o con síndrome metabólico. Por otro lado, en casos
de embarazadas, pacientes con alteraciones hematológicas o neoplásicas se prefiere la monoterapia para
evitar la leucopenia producida por azatioprina (14).
El tratamiento de primera línea se basa en la clínica del paciente y en el grado de severidad; además de los
siguientes requerimientos de tratamiento (12,14):
-
Monoterapia con prednisona o prednisolona
-
Se recomienda en pacientes donde se estima que el tratamiento va a ser menor a 6 meses o hay
contraindicaciones para utilizar azatioprina.
-
Prednisona o prednisolona en conjunto con azatioprina
-
En algunas ocasiones se recomienda iniciar la azatioprina 2 semanas posterior al esteroide para
valorar la respuesta a la prednisolona, sin embargo no hay una contraindicación para iniciar ambos medica-
mentos al mismo tiempo.
-
Una vez lograda la remisión, se inicia la titulación de la dosis del esteroide con laboratorios control
cada 2 semanas hasta lograr una dosis mínima o suspenderlo por completo y dejando una monoterapia con
azatioprina.
-
No se puede utilizar azatioprina en paciente con cirrosis descompensada o en enfermedad aguda y
severa de HAI.
-
Budesonida en conjunto con azatioprina
-
No se recomienda en paciente con cirrosis asociada o en enfermedad aguda y severa de HAI.
-
No se recomienda el uso de budesonida en pacientes que hicieron fallo terapéutico a la prednisona.
El tratamiento de segunda línea se utiliza cuando hay una falla terapéutica y en ocasiones se utilizan inhibi-
dores de la calcineurina, mercaptopurina, rituximab o infiximab (14,15).
El objetivo del tratamiento es alcanzar la remisión, la cual se define con la resolución histológica y bioquí-
mica; y la desaparición de los síntomas clínicos. Se acepta como remisión una disminución de AST a menos
de dos veces del límite superior de normalidad. La normalización de las transaminasas se logra alrededor
15
de 3-6 m de tratamiento y la remisión histológica aproximadamente 3-6 meses después de la disminución
bioquímica. El riesgo de recaída es de un 20% al posterior a lograr la remisión histológica (1).
El trasplante hepático está indicado en pacientes refractarios, intolerantes al tratamiento inmunosupresor,
cuando se desarrolla una hepatopatía terminal o en los casos de insuficiencia hepática aguda grave que no
responde a tratamiento en 1-2 semanas de tratamiento con glucocorticoides (7, 14).
CONCLUSIONES
La hepatitis autoinmune afecta principalmente al sexo femenino. La tolerancia entre los linfocitos T regu-
ladoras y las células efectoras que comparten la especificidad por las mismas regiones autoantigénicas
ocurre en pacientes sanos; si se pierde la tolerancia a los autoantígenos hepáticos se produce daño hepá-
tico autoinmune; esto se considera que ocurre tras la exposición a algunos agentes como virus, bacterias
o medicamentos. La clínica de la hepatitis autoinmune puede variar, pero suele presentarse como un cua-
dro de astenia, adinamia, anorexia, náuseas, dolor abdominal en hipocondrio derecho, artralgias, prurito.
Hasta un 44% de los pacientes presenta alguna otra enfermedad autoinmune. Para la determinación de los
autoanticuerpos ANA, AML, anti LKM, anti LC1 y anti SLA/LP es importante hacer el diagnóstico, pero la
ausencia de estos no descarta la patología y los niveles séricos no se utilizan para evaluar el progreso de la
enfermedad. Deben excluirse otras causas de hepatitis para hacer el diagnóstico de hepatitis autoinmune,
entre ellas hepatitis por virus C, alcohólica, medicamentosa y por enfermedad de Wilson.
REFERENCIAS BIBLIOGRÁFICAS
1.
Orts Costa JA, Zúñiga Cabrera A, Alarcón Torres I. Hepatitis autoinmune [Internet]. Isciii.es.
2.
Manns MP, Czaja AJ, Gorham JD, Krawitt EL, Mieli-Vergani G, Vergani D, et al. Diagnosis and
management of autoimmune hepatitis. Hepatology. 2010;51(6):2193-213.
3.
Ngu JH, Bechly K, Chapman BA, Burt MJ, Barclay ML, Gearry RB, et al. Population-based epi-
demiology study of autoimmune hepatitis: a disease of older women?: Epidemiology of autoimmune
hepatitis. J Gastroenterol Hepatol. 2010;25(10):1681-6.
4.
de Mezerville Charles Gourzong Taylor. JQGVH. HEPATITIS AUTOINMUNE (PRESENTACION
DE EN CASO Y REVISION DE TEMA [Internet]. BINASS Revista Medica de Costa Rica y Centroa-
rmcc/577/art4.pdF
5.
Parés. A. Hepatitis autoinmunes [Internet]. Sociedad espanola de medicina de laborato-
rio.
2017-2018 [citado el
tema/24/5605/459198281/1469932/cms/tema-3-hepatitis-autoinmunes.pdf/
6.
Heneghan MA, Yeoman AD, Verma S, Smith AD, Longhi MS. Autoimmune hepatitis. Lancet.
2013;382(9902):1433-44.
7.
Morillas RM, Bargalló A. Hepatitis autoinmune. Sem Fund Es Reumatol. 2008;9(3):166-73.
16
8.
Morillas R, Planas R. Gastroenterología y Hepatología, Problemas comunes en la práctica clíni-
ca. pp.747 -758: España. Editorial Jarpyo, S.A.; 2012.
9.
Poblet GG, López-Manzanares JM. Hepatitis autoinmune [Internet]. Aeped.es. [citado el 9 de
toinmune.pdf
10.
Mack CL, Adams D, Assis DN, Kerkar N, Manns MP, Mayo MJ, et al. Diagnosis and management
of autoimmune hepatitis in adults and children: 2019 practice guidance and guidelines from the Ame-
rican association for the study of liver diseases. Hepatology. 2020;72(2):671-722
11.
Feldman M, Friedman LS, Brandt LJ, editores. Sleisenger and fordtran’s gastrointestinal and
liver disease: Pathophysiology, diagnosis, management. 10a ed. Elsevier Health Sciences; 2015.
12.
Velasquez y Enrique Arus Soler MI. Hepatitis autoinmune [Internet]. Revista Scielo. 2000 [ci-
d=S0034-75232000000100008&lng=es&nrm=iso
13.
Mallo-González N, López-Rodríguez R, Campos-Franco J, Abdulkader I, Otero-Antón E, Alen-
de-Sixto MR. Síndrome overlap hepatitis autoinmune-cirrosis biliar primaria: a propósito de un caso.
An Med Interna. 2008;25(3):122-4.
14.
Mack CL, Adams D, Assis DN, Kerkar N, Manns MP, Mayo MJ, et al. Diagnosis and management
of autoimmune hepatitis in adults and children: 2019 practice guidance and guidelines from the Ame-
rican association for the study of liver diseases. Hepatology. 2020;72(2):671-722
15.
D. JIV, M. JT, G. y. CB. Clasificación de hepatitis autoinmune [Internet]. Gastrolat.org. [citado el
pdf
17