HIPOTIROIDISMO DURANTE EL EMBARAZO:
REVISIÓN BIBLIOGRÁFICA
Hypothyroidism During Pregnancy: Literature Review
Valeria Lucía Alvarado Rodríguez1 José Daniel Fonseca Figueroa2 Verónica Morales Vindas3
1,2 y 3 Estudiante de Licenciatura en Medicina y Cirugía, Escuela de Medicina, Universidad de Costa
Rica, San José, Costa Rica.
Contacto: lucialv520@gmail.com daniel.fon.fig.97@gmail.com vero14795@gmail.com
RESUMEN
Las enfermedades tiroideas están entre los trastornos endocrinos más frecuente-
mente reportados durante el embarazo, en parte debido a los cambios fisiológicos
que ocurren principalmente en el primer trimestre. En pacientes embarazadas, el
hipotiroidismo clínico tiene una prevalencia de 0.3-1.9%, mientras que el hipotiroidis-
mo subclínico de 1.5-5%. Estos porcentajes dependen de diferentes variables como
la ingesta de yodo. Se ha visto que el hipotiroidismo generalmente representa un
riesgo para la unidad materno-fetal, por lo que se debe tener en cuenta el rango de
referencia trimestral de TSH según la población para realizar un diagnóstico apro-
piado. El tratamiento consiste en levotiroxina oral, según las metas establecidas.
Además, la captación de aquellas pacientes que presenten factores de riesgo, así
como aquellas con diagnóstico previo de hipotiroidismo permite darles el segui-
Cómo citar:
miento adecuado. Por lo anterior, es necesario que los diferentes servicios cuenten
Alvarado Rodríguez,
con bases de datos a nivel regional o nacional para establecer rangos de referencia
V., Fonseca Figueroa,
trimestrales específicos para la población.
J., & Morales Vindas,
V. (2021). HIPOTIROI-
DISMO DURANTE EL
EMBARAZO. Revista
Palabras Clave: hipotiroidismo, embarazo, tamizaje, levotiroxina.
Ciencia Y Salud, 5(2),
Pág.4-14.
13/feb/2021
18/mrz/2021
4
4
ABSTRACT
Thyroid diseases are among the endocrine disorders most frequently reported du-
ring pregnancy, in part due to the physiologic changes that occur mainly in the
first trimester. In pregnant patients, clinical hypothyroidism has a prevalence of 0.3-
1.9%, while subclinical hypothyroidism has a prevalence of 1.5-5%. These percenta-
ges depend on different variables such as iodine intake. Hypothyroidism generally
represents a risk for the maternal-fetal unit, hence the need for population-based,
trimester-specific TSH reference ranges to make an appropriate diagnosis. Treat-
ment consists of oral levothyroxine, aiming for established goals. Furthermore, early
detection of patients with risk factors, as well as those with a previous diagnosis of
hypothyroidism allows for adequate follow up. Therefore, databases at a regional
or national level are required to establish population-based, trimester-specific TSH
reference ranges.
Keywords: hypothyroidism, pregnancy, screening, levothyroxine
INTRODUCCIÓN
Las enfermedades tiroideas están entre los trastornos endocrinos más frecuentemente reportados durante
el embarazo, únicamente después de la diabetes. (1) De estas, el hipotiroidismo es la patología más frecuen-
te e incluye al hipotiroidismo clínico (HC), cuya prevalencia es de 0.3-1.9% de las pacientes embarazadas,
y al hipotiroidismo subclínico (HSC), con una prevalencia de 1.5-5% de los embarazos. (2) Sin embargo,
estos porcentajes varían según el corte de hormona estimulante de la tiroides (TSH) utilizado para el diag-
nóstico, edad, región geográfica, ingesta de yodo y etnia materna. (3-5) Particularmente, la deficiencia de
yodo tiene una mayor influencia sobre la prevalencia de hipotiroidismo subclínico en comparación con la
de hipotiroidismo clínico. (5)
El embarazo es un estado que conduce a un aumento de los requerimientos de la glándula tiroides, lo que
explica la aparición de la patología tiroidea durante el periodo gestacional en pacientes con factores pre-
disponentes. Las tiroidopatías representan un riesgo tanto para la mujer embarazada como para el feto.
(6) El hipotiroidismo se ha relacionado con defectos en el desarrollo neurológico fetal y complicaciones
obstétricas. (1)
Dentro del escenario clínico, el hipotiroidismo subclínico normalmente cursa asintomático. (1) Por su parte,
el hipotiroidismo clínico puede presentar síntomas inespecíficos como debilidad, letargia, intolerancia al
frío, edema, estreñimiento y aumento de peso no atribuible a la gestación. (2,7-8) Esto conlleva a que el
diagnóstico y tratamiento de esta patología represente un reto para el clínico. Por lo anterior, el objetivo de
esta revisión es presentar la información más actualizada sobre los cambios fisiológicos en la función tiroi-
dea, complicaciones asociadas, además del tamizaje, diagnóstico y tratamiento del hipotiroidismo durante
el embarazo.
5
Metodología
Se realizó una revisión bibliográfica incluyendo ensayos clínicos, metaanálisis, guías clínicas y artículos de
revisión en las bases de datos MEDLINE, Embase, Google Académico, LILACS, SciELO y MEDES. Se utilizó
la combinación de los descriptores “hipotiroidismo” y “embarazo” para la misma. Se seleccionaron artículos
tanto en inglés como en español, publicados entre el 1 de enero del 2015 y el 20 de agosto del 2020. Dicha
búsqueda se enfocó en los artículos con mayor relevancia, escogiéndose según título y posteriormente rea-
lizando una revisión por resumen con el fin de eliminar aquellos que no estuvieran dentro de la competencia
de este trabajo. Asimismo, se revisaron las fuentes incluidas dentro de los artículos seleccionados en caso
de que fuera necesario complementar información.
Discusión
1.Fisiología de la tiroides materna
Durante el embarazo existen cambios fisiológicos que repercuten en el funcionamiento del eje hipotála-
mo-hipófisis-tiroideo, tales como:
1) Los estrógenos placentarios estimulan la producción de globulina transportadora de tiroxina (TBG)
a nivel hepático, disminuyendo los niveles de hormonas tiroideas libres. Esto es sensado a nivel central
y estimula una mayor producción de hormonas tiroideas produciendo un aumento neto de la tiroxina
(T4) total hasta alcanzar el equilibrio entre las semanas 12-14 de gestación. (1,9-10)
2) La gonadotropina coriónica humana (hCG) estimula los receptores de TSH de las células foliculares,
aumentando la producción de hormonas tiroideas de forma directa. (1)
3) Concomitantemente la hCG suprime la producción de TSH de forma indirecta vía retrocontrol ne-
gativo por el aumento de hormonas tiroideas. Este efecto alcanza un pico al final del primer trimestre,
posterior al cual los niveles de hCG disminuyen gradualmente y al mismo tiempo aumentan los niveles
de TSH. (1,10)
4) La desyodinasa tipo 3 placentaria metaboliza la T4 circulante a triyodotironina (T3) reversa. (1,4,11)
5) El feto en desarrollo consume hormonas tiroideas maternas. (1)
6) El volumen plasmático aumenta por lo que se altera el volumen de distribución de las hormonas
tiroideas. (1,11)
7) La excreción renal de yodo aumenta. (1,9-10)
Una glándula tiroides competente, capaz de incrementar los niveles de T4 y T3 un 40-50%, es necesaria
para mantener un estado materno eutiroideo y garantizar suficiente aporte para un adecuado desarro-
llo fetal. (10,12-13)
2.Fisiología de la tiroides fetal
La tiroides inicia su desarrollo derivándose del endodermo en el día 24 de gestación, durante el periodo em-
brionario. Sin embargo, la tiroides fetal empieza a producir sus propias hormonas a partir de la semana 14,
genera un aporte importante en la semana 28 y termina de madurar después del nacimiento. Esto significa
6
que un aporte materno adecuado durante la vida intrauterina es esencial para los procesos de maduración
dependientes de hormonas tiroideas. (2,4)
En el sistema nervioso en formación, la desyodinasa tipo 2 convierte la T4 en T3. Esta, por medio de re-
ceptores nucleares, modifica la expresión de genes involucrados en procesos como: proliferación neuronal,
mielinización, formación de sinapsis, diferenciación de la glía y migración celular. El impacto de las hormo-
nas tiroideas maternas en el desarrollo psicomotor se ha logrado demostrar mediante la relación entre las
áreas con deficiencia de yodo y las tasas de cretinismo. (1-2,14)
3.Hipotiroidismo clínico
3.1.Definición
El diagnóstico del HC se hace mediante la medición de TSH y T4 libre (T4L). Sin embargo, el nivel de
TSH es influenciado por los cambios fisiológicos propios del embarazo y por factores poblacionales
como la etnia y el consumo de yodo. Asimismo, los inmunoensayos, frecuentemente utilizados para
determinar los niveles T4L por su menor costo, se vuelven menos confiables debido al aumento de los
niveles de TBG sérica. Es por esto que la Asociación Americana de la Tiroides (ATA) recomienda que
cada centro de salud determine el rango de referencia trimestral de su población. (9,12)
Por lo anterior, la ATA define el HC como la presencia de TSH elevado acompañado de T4L disminuido,
según el rango de referencia trimestral específico para esa población. En caso de no contar con rangos
específicos, se puede adoptar el de poblaciones similares o en su defecto se puede tomar como límite
superior un TSH de 4.0 mUI/L. (9)
Al momento de redactar esta revisión no se encontraron publicaciones que definieran rangos de refe-
rencia específicos para la población costarricense, por lo que en la Tabla 1 se presentan rangos de TSH
y T4L descritos en estudios que incluyeron población latinoamericana.
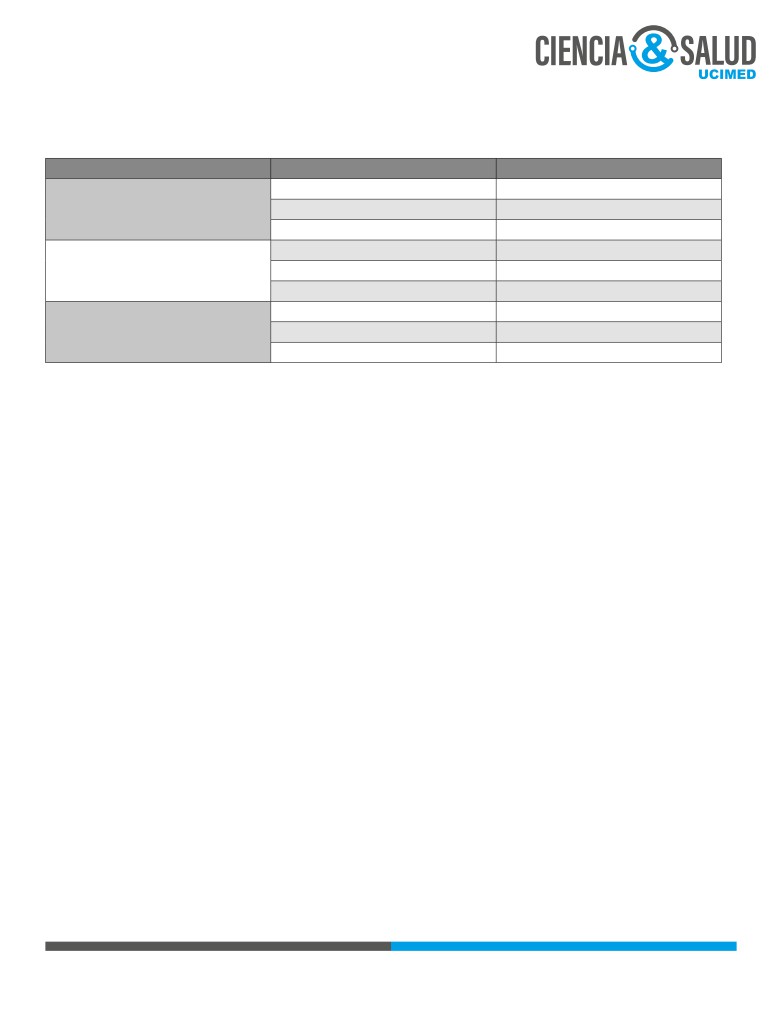
Tabla 1. Rangos de referencia de TSH y T4L descritos en estudios que incluyeron población latinoame-
ricana. (9,15)
País de
Consumo de
Periodo
Rango TSH
Rango
T4L
Investigador
origen de la
yodo de la
gestacional
(mUI/L)
(ng/dL)
investigación
población
I Trimestre
0.11-3.50
0.93-1.62
Fabbro et al.
Argentina
Suficiente
II Trimestre
0.41-5.30
0.88-1.60
III Trimestre
0.25-5.20
0.82-1.48
Lambert-
Insuficiencia
I Trimestre
0.12-3.37
0.81-1.38
Estados Unidos
Messerlian et al.
leve
II Trimestre
0.35-3.35
0.72-1.26
Insuficiencia
10-13 SDG
0.02-2.69
0.89-1.45
La’ulu et al.
Estados Unidos
leve
14-20 SDG
0.15-3.11
0.73-1.19
SDG: semanas de gestación
7
3.2.Efectos del hipotiroidismo clínico en la madre
Se han registrado múltiples complicaciones maternas en el contexto de hipotiroidismo clínico durante
el embarazo. (9) Las principales son el parto prematuro (33%), la hipertensión gestacional (22%) y la
preeclampsia (17%). (8) Otras complicaciones con menor frecuencia son aborto espontáneo, abortos
recurrentes, anemia materna y desprendimiento placentario. (6,14,16) Se ha visto que el riesgo de pér-
dida gestacional aumenta proporcionalmente al grado de elevación de la TSH. (12-13) Asimismo, se han
reportado complicaciones infrecuentes como polihidramnios, oligohidramnios, hiperémesis gravídica,
diabetes mellitus gestacional, ruptura prematura de membranas e hipertensión crónica. (8)
Es esperable que las mujeres embarazadas con un adecuado control tengan un menor riesgo de estas
complicaciones; mas no hay estudios que lo demuestren, debido a razones éticas. Sin embargo, las
guías clínicas de la ATA y el Colegio Estadounidense de Obstetras y Ginecólogos sí recomiendan iniciar
o ajustar el tratamiento con levotiroxina para evitar complicaciones obstétricas. (1,7-9)
3.3.Efectos del hipotiroidismo clínico en la descendencia
Existe suficiente evidencia del riesgo que representa el HC para el desarrollo neurocognitivo en los
descendientes de pacientes embarazadas inadecuadamente tratadas. (1,9,12) Entre los efectos adver-
sos descritos sobre parámetros del neurodesarrollo están: menor coeficiente intelectual (IQ), retraso
en el desarrollo de lenguaje, retraso en el desarrollo de habilidades motoras e inatención. (4,9,12,17)
Asimismo, se han descrito alteraciones morfológicas a nivel del hipocampo y cuerpo calloso. (1)
Además de los efectos adversos relacionados al neurodesarrollo, se ha descrito la asociación de HC
materno con malformaciones congénitas del sistema circulatorio, distrés respiratorio, muerte fetal y
bajo peso al nacer. (6,16)
4.Hipotiroidismo subclínico
4.1.Definición
El HSC se define como la presencia de TSH elevado acompañado con un nivel de T4L normal, teniendo
en cuenta los rangos de referencia trimestrales específicos para la población (7,9,11)
4.2.Rol del anti-TPO en el hipotiroidismo subclínico
Aunque alrededor de 30% de las pacientes con HSC tienen anticuerpos contra la tiroperoxidasa (an-
ti-TPO) detectables, los estudios iniciales no tomaban en cuenta estos anticuerpos como una variable.
No obstante, cada vez hay más evidencia de que estos se relacionan con mayor riesgo de eventos
adversos. (3,12)
Sullivan menciona el estudio poblacional de Korevaar et al. en el que se encontró correlación entre una
medición de TSH >4.0 mUI/L y el parto pretérmino en el cual, tras eliminar las pacientes anti-TPO (+)
de la muestra, la correlación dejó de ser estadísticamente significativa. (9,12) Incluso en pacientes eu-
tiroideas la presencia de anti-TPO está relacionada con mayores tasas de perdida gestacional y parto
pretérmino, como pudieron comprobar Negro et al. mediante ensayos controlados aleatorizados. (13)
Aunado a esto, Korevaar et al. confirman en su metaanálisis que los anti-TPO tienen un efecto dosis
dependiente tanto con el nivel de TSH como con el riesgo de parto pretérmino. (18)
8
La evidencia apunta a que los anti-TPO potencian los efectos negativos del HSC en el embarazo de
forma significativa incluso en presencia de concentraciones bajas de TSH. Es por esto que la ATA re-
comienda un punto de corte de TSH diferente para iniciar tratamiento en pacientes con HSC anti-TPO
(+) comparado con las pacientes con HSC que sean anti-TPO (-). (9)
4.3.Efectos del hipotiroidismo subclínico en la madre
Existe una mayor controversia en cuanto a los efectos adversos asociados al HSC en comparación con
el HC, pero se cree que son menos severos. (16) La inconsistencia de los datos puede explicarse en par-
te por el uso de diferentes cortes de TSH para definir el diagnóstico y la omisión de los anti-TPO como
variable. (6,12) Liu demostró mediante un metaanálisis una relación entre el HSC y el parto pretérmino.
(17) Adicionalmente, hay reportes de pérdida fetal, hipertensión gestacional, preeclampsia, presenta-
ción pélvica fetal y desprendimiento de placenta. (1-3)
En un estudio de cohortes retrospectivo se evaluó a 435 mujeres con HSC y se observó que el 17% te-
nían anti-TPO (+), lo que se asoció con una mayor probabilidad de aborto (p=0.009); sin embargo, no
se encontró asociación estadísticamente significativa con el resto de las complicaciones obstétricas.
(19)
4.4.Efectos del hipotiroidismo subclínico en la descendencia
Dentro de los eventos adversos se encuentran retraso del desarrollo intelectual y motor, riesgo aumen-
tado de trastorno del espectro autista y muerte neonatal. (1,3,17) No obstante, existe evidencia de que
el desempeño académico escolar de niños y adolescentes nacidos de madres que presentaron hipoti-
roidismo subclínico durante su embarazo no se ve comprometido. (3) Determinar de manera precisa
el efecto del HSC sobre los parámetros del desarrollo se dificulta por la influencia de múltiples factores
de confusión como la situación económica, el grado de educación de padres o cuidadores y el aspecto
sociocultural. (17,20)
5.Tamizaje universal
El hipotiroidismo cumple con varios criterios que lo harían elegible para tamizaje universal en pacientes
embarazadas: puede presentarse de manera asintomática o con síntomas que imitan cambios propios del
embarazo, tiene un examen diagnóstico bien definido, un tratamiento y es costo efectivo. Sin embargo,
particularmente en pacientes con HSC, no hay un consenso acerca de los puntos de corte para el tratamien-
to e incluso se sigue cuestionando si el tratamiento ofrece algún beneficio. (11,21)
La ATA concluye que no hay suficiente evidencia para recomendar o descartar el tamizaje universal y su
recomendación se enfoca en la búsqueda activa de casos en pacientes con factores de riesgo. (9) La efec-
tividad de la búsqueda de dichos factores también ha sido cuestionada, porque resulta en un subregistro
de al menos un tercio de las pacientes con HC. (22) Por lo anterior, varios autores recomiendan el tamizaje
universal como una estrategia más adecuada. (17)
6.Evaluación preconcepcional
Existen varios escenarios posibles en la evaluación preconcepcional. En caso de pacientes no conocidas
portadoras de tiroidopatías es necesario documentar los factores de riesgo para tiroidopatía desde antes
de la concepción (ver Tabla 2). En el caso de una paciente conocida hipotiroidea se recomienda optimizar
su tratamiento para alcanzar una meta de TSH <2.5 mUI/L, ya que hasta un 43% de las mujeres pueden
presentar TSH elevada en la primera consulta durante el embarazo y potencialmente producir HC. (9)
9
Alcanzar una TSH de 0.5-1.2 mUI/L podría evitar el cambio de dosificación, requerido por 50-85% de las
pacientes hipotiroideas. Sin embargo, inducir niveles subóptimos de TSH en algunas pacientes conlleva
riesgos desconocidos en la concepción e implantación. (9,12-13,23) Por otra parte, si la paciente no tenía un
diagnóstico previo de hipotiroidismo, pero en la primera evaluación de laboratorio tiene una TSH >4 mUI/L,
se debe realizar una segunda evaluación de TSH y si persiste alterada, se debe referir a endocrinología para
su seguimiento. (13)
Tabla 2. Factores de riesgo para desarrollar tiroidopatía durante el embarazo. (2,7,9,23)
Factores de riesgo para desarrollar tiroidopatía durante el embarazo
Antecedente personal:
Tiroidectomía
Antecedente familiar:
Enfermedad autoinmune
Hiperprolactinemia
Enfermedad tiroidea
Diabetes mellitus tipo 1
Dislipidemia
Enfermedad autoinmune
Infertilidad
Depresión
Otros antecedentes:
Edad > 30 años
Síndrome de Turner
Uso de amiodarona
Anti-TPO o Anti-TG (+)
Síndrome de Down
Uso de litio
IMC > 40
Historia de falla cardiaca
Uso de interferón
Radioterapia en cabeza o cuello
Dos o más embarazos previos
Deficiencia de yodo
Anti-TPO: anticuerpos contra tiroperoxidasa, Anti-TG: anticuerpos contra tiroglobulina
6.1.Rol del yodo
El yodo es un componente esencial de la hormona tiroidea y una ingesta insuficiente es un factor de
riesgo para el desarrollo de hipotiroidismo. (6,11) Durante el embarazo, el requerimiento de este aumen-
ta aproximadamente un 50%. (1,6) Por lo anterior, se recomienda que las pacientes tengan una ingesta
de yodo de 150 μg/d 3 meses previo al embarazo, y 250 μg/d en pacientes embarazadas, entre dieta y
suplementos orales, sin exceder los 500 μg/d. (6,9-10) Los efectos de la suplementación en la reduc-
ción de eventos adversos se han observado en áreas de deficiencia leve a severa. (11) Adicionalmente,
la yodación universal de la sal es la estrategia más costo-efectiva para preservar la función tiroidea
materna. (9)
7.Tratamiento
7.1.Hipotiroidismo clínico
Con el fin de reducir las complicaciones obstétricas asociadas al HC, se recomienda el manejo farma-
cológico con levotiroxina según el nivel de TSH (ver Tabla 3). Alternativamente, en pacientes bien con-
troladas, se puede aumentar la dosis de levotiroxina en 25-30% de la dosis diaria preconcepcional. (9)
La meta es un valor de TSH <2.5 mUI/L y se debe medir la función tiroidea cada 4-6 semanas a partir
del inicio o cambio de dosis. Una vez alcanzada la meta de tratamiento se debe revalorar al menos cada
8 semanas. (11,13,16,24) Además, no se recomienda el tratamiento con T3 por su vida media corta, los
10
riesgos de sobredosificación asociados a su uso y debido a que la barrera hematoencefálica fetal es
relativamente impermeable al T3. (9,13)
Tabla 3. Dosis diaria recomendada de levotiroxina según valor inicial de TSH. (13,16)
Investigador
Rango de TSH (mUI/L)
Dosis diaria
Vergara et al.
< 10.0
25 - 50 μg
10.0
- 20.0
50 - 100 μg
> 20.0
1.0 - 1.6 μg/kg
Belmahi et al.
2.5
- 5.0
50 μg
5.0
- 8.0
75 μg
> 8.0
100 μg
Abalovich et al.
≤ 4.2
1.2 μg/kg
≤ 10.0
1.4 μg/kg
> 10.0
2.3 μg/kg
Al prescribir levotiroxina se debe tener en cuenta sus interacciones farmacocinéticas con: inhibidores de
bomba de protones, sucralfato, colestiramina, sulfato ferroso, carbonato de calcio, fenitoína, rifampicina,
valproato y carbamacepina. (11,24)
7.2.Hipotiroidismo subclínico
La ATA recomienda iniciar el tratamiento en los siguientes casos: (1) pacientes anti-TPO (+) con TSH
mayor al rango de referencia trimestral y (2) pacientes anti-TPO (-) con TSH >10.0 mUI/L. Asimismo,
deja a criterio médico iniciar tratamiento en los siguientes casos: (1) pacientes anti-TPO (+) con TSH
entre 2.5 mUI/L y el límite superior del rango de referencia trimestral y (2) pacientes anti-TPO (-) con
TSH entre el límite superior del rango de referencia trimestral y 10.0 mUI/L. (9)
Generalmente la levotiroxina a una dosis de 50µg/d es suficiente para lograr un control adecuado.
(9,12) Cabe destacar que el sobretratamiento ha sido asociado a la presencia de trastornos conductua-
les y síntomas de trastorno de déficit atencional e hiperactividad. (25,26)
A pesar de resultados contradictorios entre estudios, se considera que el tratamiento en los grupos
señalados anteriormente reduce ciertos eventos adversos obstétricos, principalmente si el tratamiento
inicia desde el primer trimestre. (1,3,27-28) Aunque los estudios que han evaluado el efecto del trata-
miento en el neurodesarrollo de la descendencia no han mostrado beneficios, cabe destacar que estos
iniciaron el tratamiento posterior al periodo embrionario. (5,11,21)
8.Seguimiento post-parto
En pacientes que inician tratamiento con levotiroxina durante el embarazo, este se debe suspender en el
periodo postparto, mientras que en pacientes conocidas hipotiroideas debe titularse hasta alcanzar la dosis
preconcepcional, y en ambos casos hay que realizar un control de función tiroidea 4-8 semanas después.
(5-6,9) Aun así, según criterio médico puede considerarse continuar el tratamiento y monitoreo en función
de un futuro embarazo. (6)
11
CONCLUSIONES
El hipotiroidismo es una de las patologías endocrinas más comunes durante el embarazo y está asociado
a diversos efectos adversos para la unidad materno-fetal, por lo que el HC debe tratarse con levotiroxina
a partir del diagnóstico. Adicionalmente, es ideal optimizar el control en pacientes conocidas hipotiroideas
previo y durante el embarazo. Por otro lado, aún no se cuenta con evidencia suficiente para recomendar
el tamizaje universal ni el tratamiento de todas las pacientes con HSC, siendo necesario individualizar los
casos según el criterio médico.
Por su parte, se recomienda que los distintos servicios inicien programas de recolección estadística y elabo-
ren una base de datos a nivel regional o nacional para establecer rangos de referencia trimestrales especí-
ficos para la población. A partir de esto se puede determinar la prevalencia e incidencia del hipotiroidismo
durante el embarazo en la población costarricense para definir protocolos de atención.
Conflictos de interés
No hay ningún conflicto de interés por declarar.
Financiamiento
Los autores no recibieron ningún financiamiento por o para la realización de este artículo.
REFERENCIAS BIBLIOGRÁFICAS
1. Delitala A, Capobianco G, Cherchi P, Dessole S, Delitala G. Thyroid function and thyroid disorders du-
ring pregnancy: a review and care pathway. Arch Gynecol Obstet. 2018;299(2):327-338. DOI: 10.1007/
s00404-018-5018-8
2. López-Muñoz E, Mateos-Sánchez L, Mejía-Terrazas G, Bedwell-Cordero S. Hypothyroidism and iso-
lated hypothyroxinemia in pregnancy, from physiology to the clinic. Taiwan J Obstet Gynecol [In-
gov/31759523/. DOI: 10.1016/j.tjog.2019.09.005
3. Toloza F, Abedzadeh-Anaraki S, Maraka S. Subclinical hypothyroidism in pregnancy. Curr Opin En-
docrinol Diabetes Obes. 2019;26(5):225-231. DOI: 10.1097/MED.0000000000000491
4. Batistuzzo A, Ribeiro M. Clinical and subclinical maternal hypothyroidism and their effects
on neurodevelopment, behavior and cognition. Arch Endocrinol Metab
[Internet].
2020
[Consultado
24 ag
d=S2359-39972020000100089&script=sci_arttext DOI: 10.20945/2359-3997000000201
5. Shan Z, Teng W. Thyroid hormone therapy of hypothyroidism in pregnancy. Endocrine. 2019;66(1):35-
42. DOI: 10.1007/s12020-019-02044-2
6. Belmahi N, Boujraf S, El-Ouahabi H. Thyroid and Pregnancy. Reprod Dev Med [Internet]. 2018
n=2096-2924;year=2018;volume=2;issue=3;spage=162;epage=170;aulast=Belmahi DOI: 10.4103/2096-
2924.248487
7. Thyroid Disease in Pregnancy. Obstetrics & Gynecology. 2020;135(6):e261-e274. DOI: 10.1097/
aog.0000000000003893
8. Shinohara D, Santos T, de Carvalho H, Lopes L, Günther L, Aristides S et al. Pregnancy Complications
12
Associated With Maternal Hypothyroidism. Obstet Gynecol Surv. 2018;73(4):219-230. DOI: 10.1097/
OGX.0000000000000547
9. Alexander E, Pearce E, Brent G, Brown R, Chen H, Dosiou C et al. 2017 Guidelines of the American
Thyroid Association for the Diagnosis and Management of Thyroid Disease During Pregnancy and the
Postpartum. Thyroid [Internet]. 2017 [Consultado 24 ag 2020];27(3):315-389. Disponible en: https://
pubmed.ncbi.nlm.nih.gov/28056690/. DOI: 10.1089/thy.2016.0457
10. Sterrett M. Maternal and Fetal Thyroid Physiology. Clin Obstet Gynecol. 2019;62(2):302-307. DOI:
10.1097/GRF.0000000000000439
11. Taylor P, Lazarus J. Hypothyroidism in Pregnancy. Endocrinol Metab Clin N Am. 2019;48(3):547-556.
DOI: 10.1016/j.ecl.2019.05.010
12. Sullivan S. Hypothyroidism in Pregnancy. Clin Obstet Gynecol. 2019;62(2):308-319. DOI: 10.1097/
GRF.0000000000000432
13. Vergara P, Araya V, Sepúlveda-Martínez A, Parra-Cordero M. Manejo de la enfermedad tiroídea en el
embarazo y puerperio. Rev Hosp Clin Univ Chile [Internet]. 2019 [Consultado 24 ag 2020];30:153-172.
14. Ayala-Yáñez R, Velasco-Sordo R, Alfaro-Alfaro J. Repercusiones del hipotiroidismo al principio del
embarazo: consideraciones para mejorar el diagnóstico y la intervención. Ginecol Obstet Mex [Inter-
cgi-bin/new/resumen.cgi?IDARTICULO=73307
15. Fabbro D, Oneto A, Smithuis F, Hernández S, Papaleo N, Cárcano M et al. Distribución de los va-
lores de hormonas del eje tiroideo en una población de embarazadas. Rev Argent Endocrinol Metab
ros/2013-vol50/suplemento/index.html
16. Yalamanchi S, Cooper D. Thyroid disorders in pregnancy. Curr Opin Obstet Gynecol. 2015;27(6):406-
415. DOI: 10.1097/GCO.0000000000000226
17. Liu Y, Chen H, Jing C, Li F. The Association Between Maternal Subclinical Hypothyroidism and Grow-
th, Development, and Childhood Intelligence: A Meta-analysis. J Clin Res Pediatr Endocrinol [Internet].
cles/PMC5985385/. DOI: 10.4274/jcrpe.4931
18. Korevaar T, Pop V, Chaker L, Goddijn M, de Rijke Y, Bisschop P et al. Dose Dependency and a Func-
tional Cutoff for TPO-Antibody Positivity During Pregnancy. J Clin Endocrinol Metab [Internet]. 2018
DOI: 10.1210/jc.2017-01560
19. López-Tinoco C, Rodríguez-Mengual A, Lara-Barea A, Barcala J, Larrán L, Saez-Benito A et al. Im-
pacto de la autoinmunidad antitiroidea positiva en gestantes con hipotiroidismo subclínico. Endocrinol
Diabetes Nutr. 2018;65(3):150-155. DOI: 10.1016/j.endinu.2017.11.013
20.
Martínez M, Soldevila B, Lucas A, Velasco I, Vila L, Puig-Domingo M. Hypothyroidism during
pregnancy and its association to perinatal and obstetric morbidity: a review. Endocrinol Diabetes Nutr.
2018;65(2):107-113. DOI: 10.1016/j.endinu.2017.11.009
21. Casey B, Thom E, Peaceman A, Varner M, Sorokin Y, Hirtz D et al. Treatment of Subclinical Hypothyroi-
dism or Hypothyroxinemia in Pregnancy. NEJM [Internet]. 2017 [Consultado 24 ag 2020];376(9):815-
10.1056/NEJ-
Moa1606205
22.
Krassas G, Karras S, Pontikides N. Thyroid diseases during pregnancy: A number of impor-
tant issues. Hormones (Athens) [Internet]. 2015 [Consultado 24 ag 2020];14(1):59-69. Disponible en:
23.
Abalovich M, Alcaraz G, Ase E, Bergoglio L, Cabezon C, Gutierrez S et al. Guía de tiroides y
embarazo. Rev Argent Endocrinol Metab [Internet]. 2016 [Consultado 24 ag 2020];53(1):5-15. Dispo-
13
10.1016/j.raem.2016.05.003
24.
Muñoz J, Vorhauer S, Rodríguez R, Macedo A, Villagomez M, Ayala R. Hipotiroidismo y emba-
razo. An Med (Mex) [Internet]. 2019 [Consultado 24 ag 2020];64(2):111-117. Disponible en: https://www.
medigraphic.com/cgi-bin/new/resumen.cgi?IDARTICULO=87594
25.
Yamamoto J, Metcalfe A, Nerenberg K, Khurana R, Chin A, Donovan L. Thyroid function tes-
ting and management during and after pregnancy among women without thyroid disease before preg-
nancy. CMAJ [Internet]. 2020 [Consultado 24 ag 2020];192(22):E596-E602. Disponible en: https://
26.
Hales C, Taylor P, Channon S, Paradice R, McEwan K, Zhang L et al. Controlled Antenatal
Thyroid Screening II: Effect of Treating Maternal Suboptimal Thyroid Function on Child Cognition. J Clin
Endocrinol Metab [Internet]. 2018 [Consultado 22 set 2020];103(4):1583-1591. Disponible en: https://
pubmed.ncbi.nlm.nih.gov/29346569/. DOI: 10.1210/jc.2017-02378
27.
Nazarpour S, Ramezani Tehrani F, Amiri M, Bidhendi Yarandi R, Azizi F. Levothyroxine treat-
ment and pregnancy outcomes in women with subclinical hypothyroidism: a systematic review and
meta-analysis. Arch Gynecol Obstet. 2019;300(4):805-819. DOI: 10.1007/s00404-019-05245-2
28.
Dong A, Stephenson M, Stagnaro-Green A. The Need for Dynamic Clinical Guidelines: A Syste-
matic Review of New Research Published After Release of the 2017 ATA Guidelines on Thyroid Disease
During Pregnancy and the Postpartum. Front Endocrinol [Internet]. 2020 [Consultado 24 ag 2020];11.
do.2020.00193
14