Tromboembolismo pulmonar: abordaje diagnóstico y manejo.
Pulmonary Embolism: diagnostic workup and management
Natalia Jiménez Sánchez 1
1 Médico general, Caja costarricense de seguro social, Alajuela Costa Rica.
Contacto: njimenezs@gmail.com
RESUMEN
El tromboembolismo pulmonar (TEP) representa un continuo de la enfermedad
tromboembólica, y como tal la mayoría de los pacientes con TEP asocia un evento de
trombosis venosa profunda en miembros inferiores. Su mortalidad es variable, según
las comorbilidades del paciente, sus factores de riesgo y el grado de severidad al
momento de la presentación.
Su clasificación y estratificación dependen del grado de obstrucción y compromiso
del ventrículo derecho, así como de una alta sospecha clínica que permita guiar el
trabajo diagnóstico por buen camino.
El objetivo principal de esta revisión consiste en exponer de la forma más clara y
concisa el trabajo diagnóstico que el clínico debe realizar para descartar o confirmar
un tromboembolismo pulmonar, iniciando por evaluar la probabilidad pre-test que
tenga el individuo al momento de su presentación.
Ya que el cuadro clínico para esta patología es amplio y los costos de diagnóstico
Cómo citar:
y manejo son considerables, es fundamental una valoración sistemática que incluya
Jiménez Sánchez, N.
la clínica y las pruebas diagnósticas necesarias según un balance costo/beneficio
Tromboembolismo
pulmonar: abordaje
adecuado.
diagnóstico y manejo.
Revista Ciencia Y
Palabras Clave: Tromboembolismo pulmonar, enfermedad tromboembólica,
Salud Integrando
trombosis venosa profunda
Conocimientos, 5(5),
ABSTRACT
doi.org/10.34192/
cienciaysalud.v5i5.267
Pulmonary embolism (PE) belongs to the set of thromboembolic disorders, and as
such, most of the patients presenting with PE also present deep vein thrombosis of
the lower limbs. Its mortality is variable, according to the patient’s comorbidities, risk
factors and the degree of severity at the moment of presentation.
02/mar/2021
14/oct/2021
18/oct/2021
7
7
Its classification and stratification both depend on the degree of obstruction and
right ventricle compromise, as well as a high level of clinical suspicion that would
allow for the correct diagnostic path.
The main objective of this review is to present as clearly and concisely as possible
the diagnostic work that the clinician must perform to either rule out or confirm a
pulmonary embolism, beginning by evaluating the patient’s pre-test probability at
the moment of presentation.
Since the clinical picture for this disease is wide and the costs of diagnosis and
management are considerable, it is necessary a systematic evaluation that takes into
account the clinical signs in conjunction with the ancillary tests needed following an
adequate cost/benefit balance.
Keywords: Pulmonary embolism, thromboembolic disease, deep vein thrombosis.
INTRODUCCIÓN
El tromboembolismo pulmonar (TEP) representa un continuo de la enfermedad tromboembólica, y
como tal se suele estudiar en conjunto con la trombosis venosa profunda. Un 79% de los pacientes con
tromboembolismo pulmonar tiene evidencia de trombosis venosa profunda en miembros inferiores (1).
Adicional a esto, un 50% de los pacientes con TEP tiene trombosis venosa profunda de localización proximal
(1).
La incidencia del tromboembolismo pulmonar en los Estados Unidos se calcula en 1 episodio por cada
100,000 pacientes anualmente (1), mientras que del otro lado del mundo, en Australia y Nueva Zelanda, la
incidencia alcanza los 50-75 casos por cada 1000 personas (2). La mortalidad del TEP a los 30 días oscila
entre 0,5%-20% dependiendo de los síntomas al momento de la presentación (3), mientras que a 90 días
ronda el 10-15% (4). En los Estados Unidos, la mortalidad del TEP ronda los 300,000 casos anualmente,
la mayoría de los cuales se diagnostican post-mortem (1). A nivel latinoamericano existen escasos datos
epidemiológicos: en Argentina se estima que la mortalidad ronda el 14,1%, mientras que en Brasil es de 19%
(4).
MATERIALES Y MÉTODOS
Se realizó un estudio descriptivo cualitativo tras una revisión bibliográfica de la base de datos PubMed®
seleccionaron artículos entre el año 2000 y 2021. Los artículos más antiguos que permanecieron tras la
revisión inicial corresponden a aquellos con datos clave que han marcado un antes y un después en el
diagnóstico y manejo de la patología, así como aquellos con datos epidemiológicos de interés. Se seleccionó
un total de 19 artículos tras la revisión inicial.
Siendo el tromboembolismo pulmonar un tema de abordaje primario en el ámbito de los servicios de
emergencias, se decidió también la revisión del capítulo concerniente a esta patología en un prominente
libro de texto para esta especialidad.
Adicional a la revisión bibliográfica, se realizó una búsqueda en Internet de material didáctico en prominentes
sitios web de educación médica gratuita de acceso abierto para la ilustración de los conceptos utilizados
en este artículo.
La autora no tiene conflictos de interés que declarar.
8
FISIOPATOLOGÍA
El trombo responsable de la obstrucción a nivel de arterias pulmonares tiene su génesis al coexistir las
siguientes entidades patológicas: hipercoagulabilidad, estasis y daño endotelial. Históricamente a estas
se les ha denominado en grupo como la Tríada de
Virchow (5). Más adelante se expondrán los factores
de riesgo para el tromboembolismo pulmonar, y el
lector podrá correlacionar entonces que la causa
contribuyente usualmente se clasifica dentro de
alguno de los componentes de la Tríada.
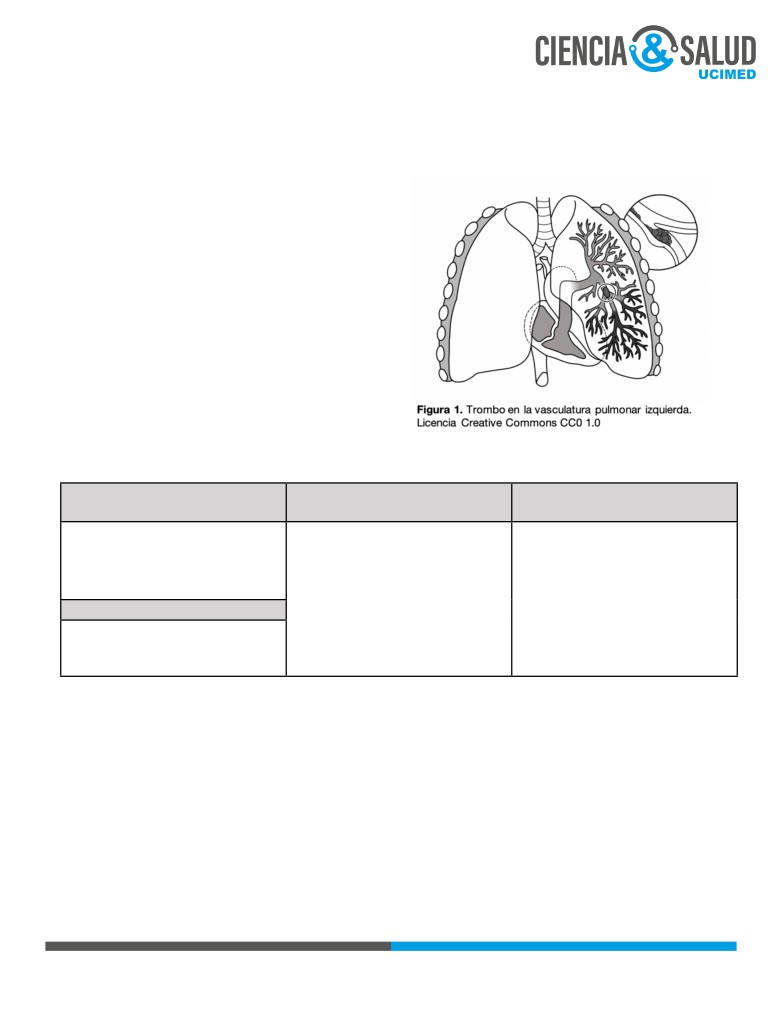
Estos trombos se originan principalmente en las
válvulas venosas de los miembros inferiores (zonas
ideales de estasis) (1), y en un momento determinado
embolizan hasta las cámaras derechas del corazón y
de ahí hasta los pulmones.
Una vez que el trombo se ubica en la vasculatura
pulmonar, puede obstruir completa o parcialmente
el vaso, lo que aumenta la presión pulmonar y da
pie a desbalances ventilación/perfusión
(2) y
eventualmente a infarto pulmonar.
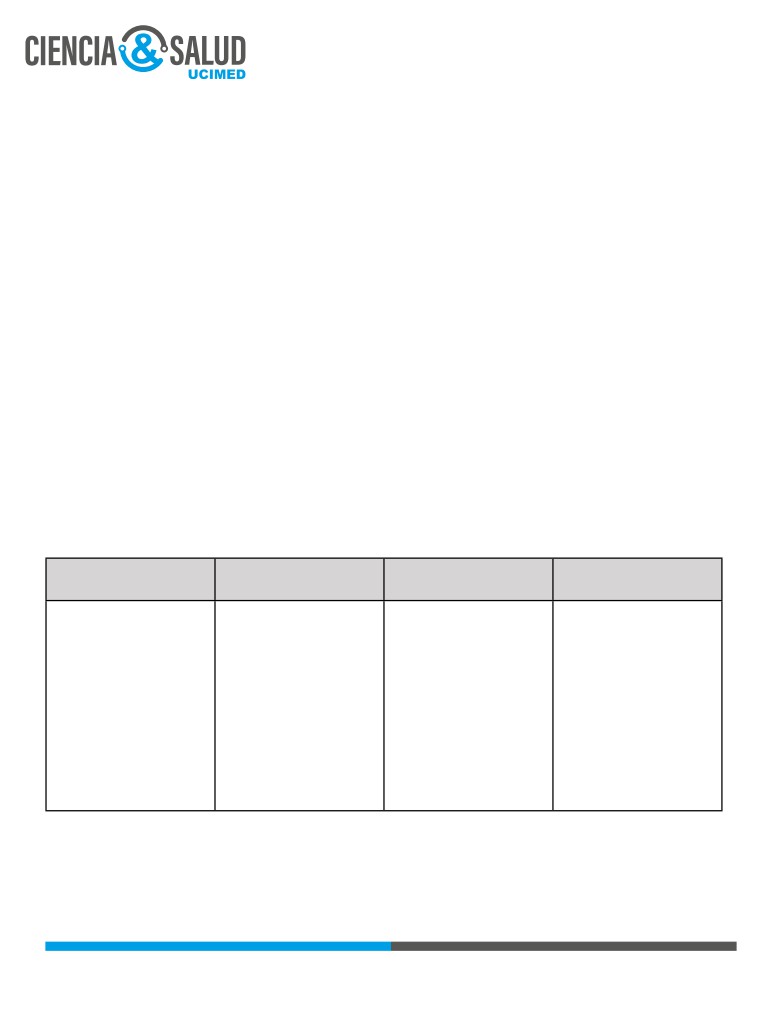
Tabla 1. Clasificación del tromboembolismo pulmonar (6).
TEP MASIVO
TEP SUBMASIVO
BAJO RIESGO
Hipotensión
persistente;
No hay hipotensión,
No hay hipotensión ni
PAS <90mmHg por más de
sin
embargo presenta
disfunción de ventrículo
15 minutos o que requiera
disfunción
del
derecho.
soporte inotrópico.
ventrículo derecho
(VD)
Bradicardia <40lpm.
documentada por imagen
Ausencia de pulso.
(TAC o ecocardiograma)
ó
elevación
de
biomarcadores.
FACTORES DE RIESGO
Existen ciertas características y factores específicos que aumentan el riesgo de un evento del tipo
tromboembolismo pulmonar. Hasta un 85% de los pacientes que desarrollan un TEP tienen comorbilidades
crónicas (6). Tradicionalmente se han clasificado en modificables y no modificables, o como se detallará a
continuación en hereditarios y adquiridos:
9
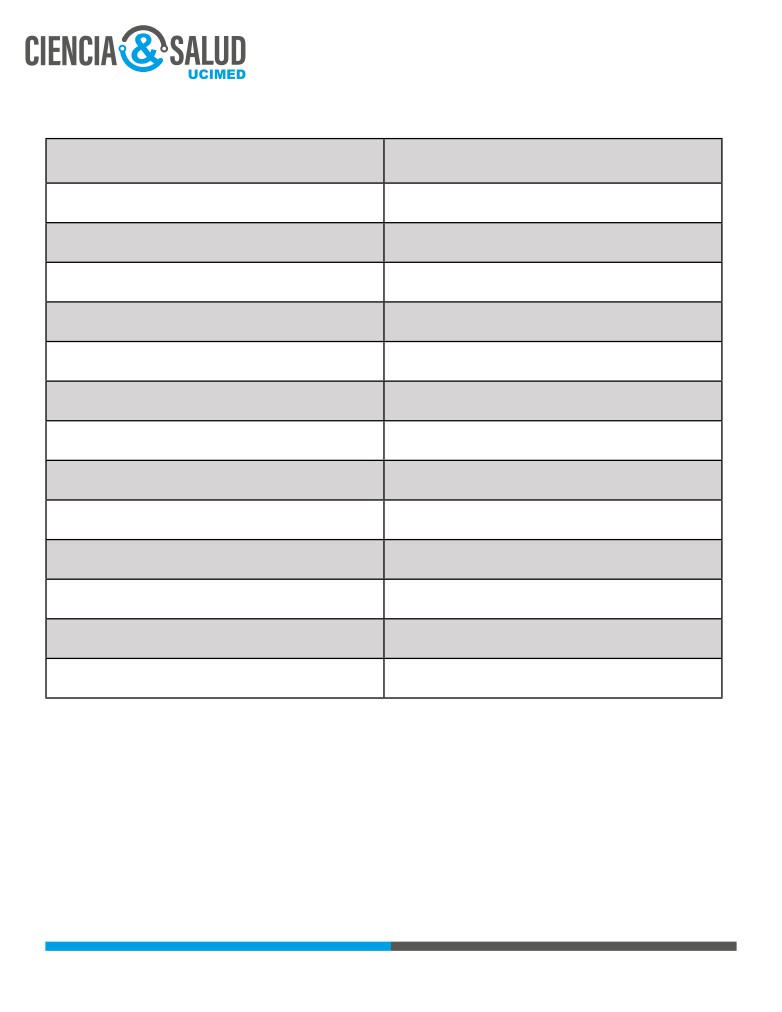
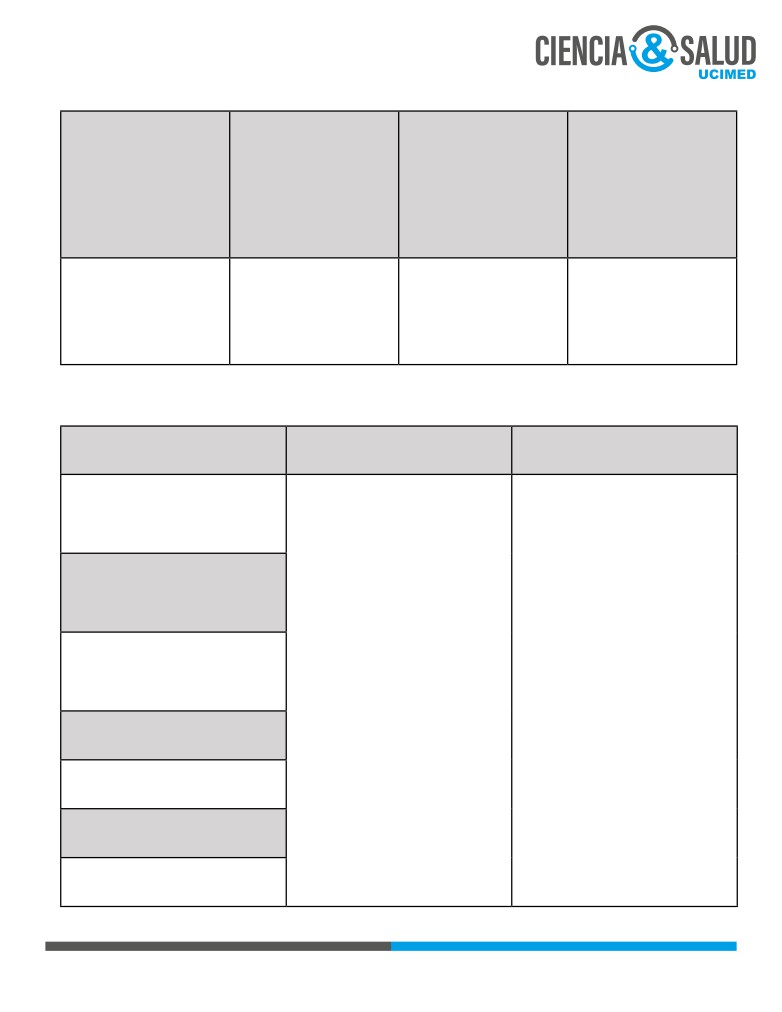
Tabla 2. Factores de riesgo para tromboembolismo pulmonar (1).
Factores hereditarios
Factores adquiridos
Movilidad reducida / inmovilización
Deficiencia de antitrombina
prolongada
Deficiencia de proteína C y S
Edad avanzada
Factor V de Leiden
Cáncer
Mutación del gen de la protrombina
Enfermedad aguda
Mutación en el gen de la protrombina
Cirugía mayor / trauma
Disfribinogenemia
Lesión de médula espinal
Deficiencia de plasminógeno
Embarazo y postparto
Policitemia vera
Síndrome de anticuerpos antifosfolípidos
Anticonceptivos orales / terapia reemplazo
hormonal
Drogas como heparinas*, quimioterapéuticos
Obesidad
Cateterización venosa central
(*) Trombocitopenia inducida por heparina (HIT en inglés) es una reacción mediada por anticuerpos IgG
que ocurre hasta en un 8% de los pacientes que reciben terapia con heparinas. En un 25% de los pacientes,
un evento de trombosis (TVP ó TEP) precede la aparición de la trombocitopenia (7).
MANIFESTACIONES CLÍNICAS
La disnea es el síntoma más frecuente del tromboembolismo pulmonar (5, 8, 1). Se acompaña de dolor
torácico de tipo pleurítico, ya sea de inicio súbito o insidioso, taquipnea, taquicardia, tos, hemoptisis (8).
10
Originalmente se determinó que hasta un 16,1% de las exacerbaciones agudas de EPOC sin desencadenante
claro puede deberse a un TEP (6); sin embargo un estudio francés más reciente determinó que la prevalencia
de TEP en estos pacientes ronda el 5,9% (9).
Puede haber hipoxemia, sin embargo es de grado variable, aproximadamente la mitad de los pacientes con
TEP no la presenta (5).
El tromboembolismo pulmonar también puede presentarse como paro cardíaco, siendo la actividad eléctrica
sin pulso (AESP) el ritmo más frecuentemente encontrado (5).
ESTRATIFICACIÓN DE RIESGO
Actualmente existe variedad de puntuaciones clínicas (accesibles mediante aplicaciones móviles y/o
Internet) ya validadas en múltiples instancias (servicios de emergencias, hospitalización) que contribuyen a
agilizar la estratificación y toma de decisiones en pacientes sospechosos de tromboembolismo pulmonar.
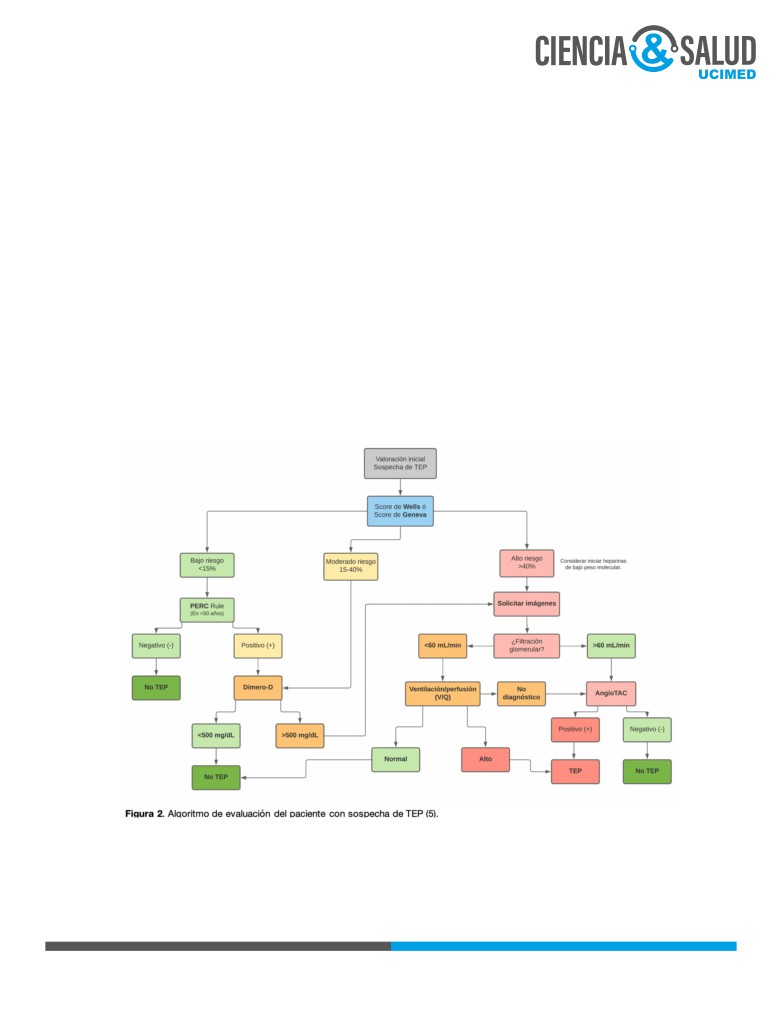
Los criterios de Wells permiten estandarizar el juicio clínico ante el escenario de un TEP agudo previo al
inicio del trabajo diagnóstico (2). El puntaje de Geneva (Ginebra) es otra herramienta que se puede utilizar
en vez de los criterios de Wells para valorar la probabilidad pre-test.
Dependiendo del puntaje obtenido en los criterios de Wells o el score de Geneva, se puede estratificar
entonces el riesgo en bajo (<15%), moderado (15-40%) o alto (>40%) y así proseguir el trabajo diagnóstico
(3, 5) tal y como se muestra en la Figura 2.
Una vez que se determina que el paciente es de bajo riesgo para tromboembolismo pulmonar, se utiliza un
score adicional, la regla PERC (Pulmonary Embolism Rule-Out Criteria). Este puntaje pretende el descarte
clínico de los pacientes de bajo riesgo para evitar la sobreutilización de recursos consumibles (10).
11
La presencia de al menos un criterio positivo impide descartar un TEP y requiere la aplicación de Dímero-D,
a saber:
• Edad ≥ 50 años.
• Frecuencia cardíaca ≥ 100 lpm.
• Saturación de oxígeno <95% en aire ambiente.
• Edema unilateral de pierna.
• Hemoptisis.
• Cirugía o trauma reciente (<4 semanas).
• Uso de hormonas
Tabla 3. Puntajes clínicos de Wells y Geneva (11).
Wells Score
Puntos
Geneva Score
Puntos
Signos y síntomas clínicos
3
Edad >65 años
1
de TVP
TEP es el diagnóstico
Antecedente de enfermedad
probable #1 o igual de
3
3
tromboembólica (TEP ó TVP)
probable
Inmovilización de al menos
Cirugía bajo anestesia general
3 días ó cirugía en las 4
1,5
de miembros inferiores o
2
semanas previas
fractura
Frecuencia cardíaca (FC)
1,5
Malignidad activa o <1 año
2
>100 lpm
Antecedente de enfermedad
Dolor de miembro inferior
tromboembólica (TEP o
1,5
3
unilateral
TVP)
Hemoptisis
1
Hemoptisis
2
FC <75 lpm
0
Malignidad en tratamiento
en los 6 meses previos o
1
FC 75-94 lpm
3
paliativo
FC ≥95 lpm
5
Dolor a la palpación de
miembro inferior y edema
4
unilateral
Probabilidad clínica
Probabilidad clínica
-Baja: 0-3 puntos
-Baja: 0 puntos
-Moderada: 4-10 puntos
-Moderada: 1-2 puntos
-Alta: ≥11 puntos.
-Alta: ≥3 puntos
12
ESTUDIOS DE LABORATORIO Y GABINETE
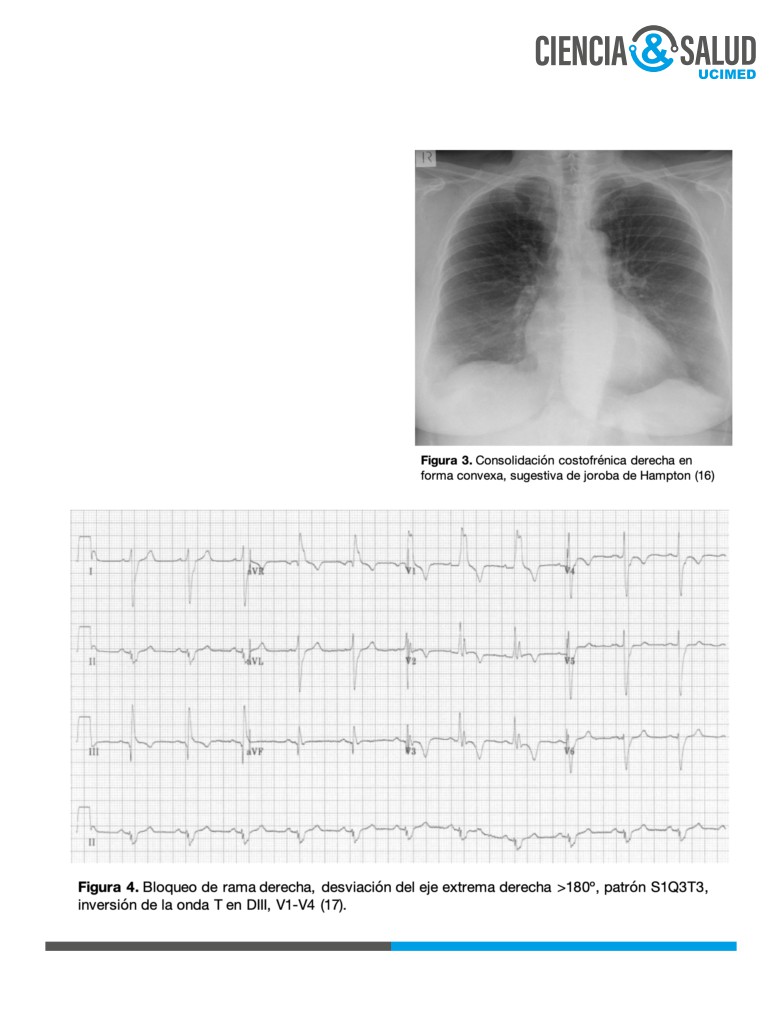
La radiografía de tórax se utiliza principalmente
para la exclusión de otras causas como neumonía,
insuficiencia cardíaca congestiva o neumotórax. En
ocasiones (principalmente cuando la sintomatología
ha estado presente por más de 3 días) se puede
apreciar la presencia de una opacidad pleural en
forma de cuña llamada Hampton’s Hump (joroba de
Hampton), indicativa de infarto pulmonar (1, 5).
El electrocardiograma en el contexto de un TEPmasivo
arroja una serie de hallazgos fisiopatológicamente
interesantes, sin embargo poco específicos desde el
punto de vista diagnóstico (5), como los siguientes
en frecuencia de aparición:
1. Taquicardia sinusal 2. Inversión de la onda T 3.
Bloqueo de rama derecha del Haz de His 4. Patrón
S1Q3T3.
Como se mencionó previamente, el Dímero-D
es el producto de la proteólisis de la fibrina en el
trombo. Tiene un alto valor predictivo negativo y
como tal, se utiliza para la exclusión de enfermedad
tromboembólica.
13
Su valor límite debe ser ajustado para personas mayores de 50 años, ya que se ha demostrado que la
especificidad disminuye con la edad (12). Se ha determinado entonces que el valor corte ideal para mayores
de 50 años se calcula multiplicando la edad por un factor de 10 (60 años x 10ng/mL = 600ng/mL) (13, 14) y
de esta forma (combinado con la probabilidad clínica) se puede excluir con seguridad la presencia de TEP
(15).
El uso de otros biomarcadores como troponinas y el péptido natriurético tipo-B (BNP) y pro-BNP son de
utilidad pronóstica y su elevación se asocia a la disfunción de ventrículo derecho (18).
El gold standard para el diagnóstico de tromboembolismo pulmonar recae en la angiografía por tomografía
computarizada, o AngioTAC. Este medio de imagen permite la visualización del trombo en la vasculatura
pulmonar mediante el uso de medio de contraste.
MANEJO
Una vez que se tiene el diagnóstico confirmado de tromboembolismo pulmonar, se procede entonces a
clasificar al paciente según los hallazgos de laboratorio y gabinete junto con su estado clínico.
En este apartado se puede recurrir nuevamente a la utilización de scores clínicos para determinar la
severidad y riesgo de mortalidad (PESI Score) y la posibilidad o no de manejo ambulatorio (HESTIA Score).
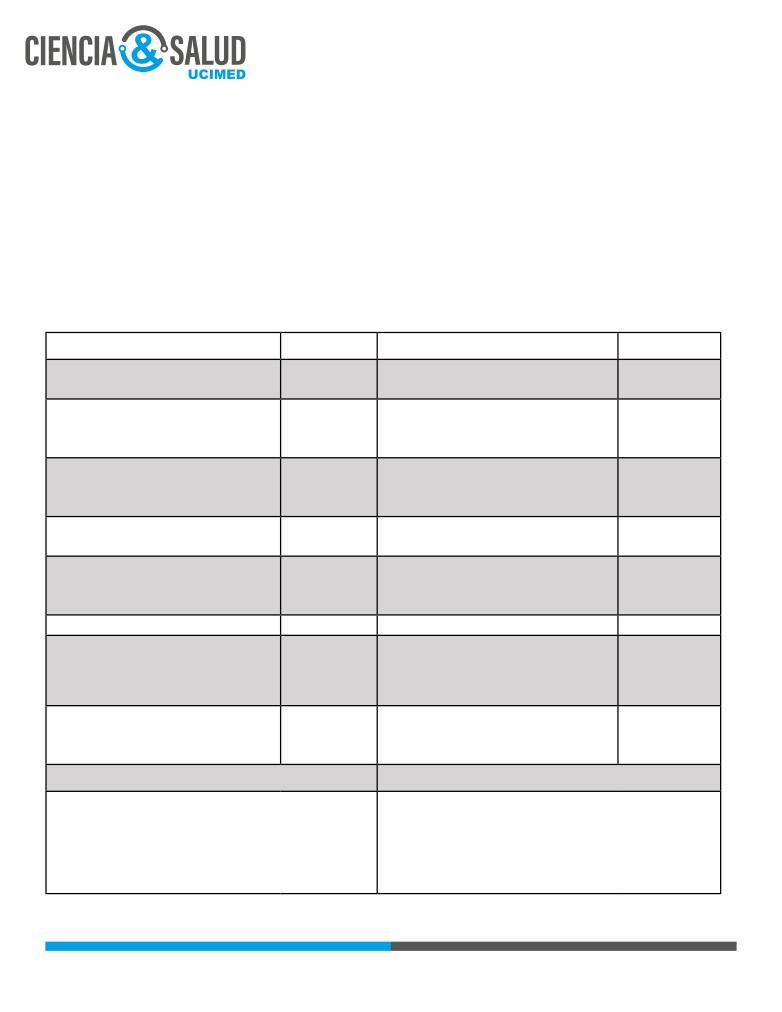
Tal y como se puede observar en la Tabla 4, el manejo principal consistirá de anticoagulación en todos los
pacientes y fibrinolisis a partir del riesgo moderado/inestabilidad hemodinámica, sin embargo en el caso
en que esta última esté contraindicada (<5% de los casos), se debe valorar la opción de embolectomía
quirúrgica (19).
El manejo anticoagulante cambiará según el tiempo de evolución del paciente desde el evento trombótico
tal y como se muestra en la Tabla 5. Se prefiere el uso de heparinas de bajo peso molecular o fondaparinux
por su mayor facilidad de uso y eficacia comparable con la heparina no fraccionada (18).
Tabla 4. Manejo del TEP según el riesgo de presentación (5).
BAJO RIESGO
MODERADO RIESGO
MODERADO-ALTO
ALTO RIESGO
PESI Score 0pts, HESTIA
negativo.
PAS >90mmHg y AL
PAS >90mmHg.
MENOS UNO DE LOS
Cualquier criterio de
No trombo proximal.
SIGUIENTES:
PAS <90mmHg ó
RIESGO MODERADO +
<20mmHg de lo
No dilatación VD.
Trombo proximal.
distrés respiratorio.
documentado en los
Shock index <1.
VD > VI, hipoquinesis de
SatO2 <90mmHg.
parámetros de base +
VD.
SatO2 >94%.
distrés respiratorio.
Alteración del sensorio.
Algún biomarcador
Daniel Score <3.
elevado.
Biomarcadores
normales.
14
Anticoagulación
Anticoagulación con
Anticoagulación con
Anticoagulación, valorar
(heparinas de bajo
heparina no fraccionada,
heparina no fraccionada,
el uso de fibrinolíticos
peso molescular de
valorar uso de
valorar uso de
(minoría).
preferencia).
fibrinolíticos (mayoría).
fibrinolíticos (mayoría).
Ingreso a Unidad de
Manejo ambulatorio.
Ingreso hospitalario.
Ingreso hospitalario.
Cuidados Intensivos
(UCI).
Tabla 5. Opciones de anticoagulación en el paciente con TEP (18).
Tratamiento extendido
Manejo inicial ≥5 días
Largo plazo ≥3 meses
(indefinido)
Heparina no fraccionada
(80 IU/
kg bolo inicial, 18 IU/kg/hr hasta un
TTPa de 1,5-2,5.
Heparinas de bajo peso molecular
(Enoxaparina 1mg/kg SC BID)
Fondaparinux
<50kg: 5mg SC QD
50-100kg: 7,5mg SC QD
Antagonistas de la
Antagonistas de la
Vitamina K (INR 2-3 ó 1,5-
>100kg: 10 mg SC QD
Vitamina K (INR 2-3)
1,9)
Trombolisis
Embolectomía
Cirugía
Antagonistas de la Vitamina K (INR
2-3)
15
PRONÓSTICO Y MORTALIDAD
El pronóstico de un caso de tromboembolismo pulmonar se ve influenciado inicialmente por su clasificación
(masivo/submasivo) así como la edad y las comorbilidades del paciente. Aunque parezca contradictorio, se
ha determinado que el pronóstico de los pacientes con un TEP no asociado a factores de riesgo es menos
favorable que el de aquellos portadores de algún factor hereditario o adquirido (20).
En el corto plazo, Shah et al., evaluaron los reingresos hospitalarios y mortalidad a 90 días del evento. En
su estudio con 260,214 pacientes (la mayoría padecía hipertensión arterial, diabetes mellitus, enfermedad
pulmonar obstructiva crónica u obesidad), los investigadores obtuvieron una tasa de reingresos hospitalarios
de 21,36% en los primeros 90 días (la mayoría por malignidad) y una tasa de mortalidad de 4,92% (21).
Aún después de sobrevivir al evento agudo, los pacientes pueden complicarse por otros eventos adversos
trombóticos y no trombóticos (hemorragias, hipertensión pulmonar) (20).
En el mediano y largo plazo, la mortalidad a 3-6 meses en diversos estudios clínicos aleatorizados oscila
entre 0 y 4,7% (22). La mortalidad general a un año ronda el 25%, y por lo general se debe a comorbilidades
asociadas como cáncer o cardiopatía (20).
REFERENCIAS BIBLIOGRÁFICAS
1.
Tapson VF. Acute Pulmonary Embolism. New Engl J Med. 2013;358(10):1037-52.
2.
Hepburn-Brown M, Darvall J, Hammerschlag G. Acute pulmonary embolism: a concise review of
diagnosis and management. Intern Med J. 2019;49(1):15-27.
3.
Kearon C, De Wit K, Parpia S, Schulman S, Afilalo M, Hirsch A, et al. Diagnosis of pulmonary
embolism with d-dimer adjusted to clinical probability. New Engl J Med. 2019;381(22):2125-34.
4.
Ceresetto JM. Venous thromboembolism in Latin America: A review and guide to diagnosis and
treatment for primary care. Clinics. 2016;71(1):36-46.
5.
Kline JA. Pulmonary Embolism and Deep Vein Thrombosis. En: Rosen’s Emergency Medicine:
Concepts and Clinical Practice 9th Edition. 2018. p. 1051-66.
6.
Essien EO, Rali P, Mathai SC. Pulmonary Embolism. Med Clin North Am. 2019;103(3):549-64.
7.
Bircan, H. A., & Alanoglu, E. G. (2016). Massive Pulmonary Embolism in a Patient with Heparin
Induced Thrombocytopenia: Successful Treatment with Dabigatran. The Eurasian Journal of Medicine,
8.
Martínez-González, Mayra; Castañón-González JA. Enfermedad tromboembólica venosa en la
unidad de cuidados intensivos. Rev Médica IMSS. 2001;40(3):233-45.
9.
Couturaud F, Bertoletti L, Pastre J, Roy P-M, Le Mao R, De Magalhaes E, et al. Prevalence of
Pulmonary Embolism Among Patients With COPD Hospitalized With Acutely Worsening Respiratory
Symptoms. JAMA - J Am Med Assoc. 2021;325(1):59-68. doi:10.1001/jama.2020.23567
10.
Kline JA, Mitchell AM, Kabrhel C, Richman PB, Courtney DM. Clinical criteria to prevent
unnecessary diagnostic testing in emergency department patients with suspected pulmonary
embolism. J Thromb Haemost. 2004;2(8):1247-55.
11.
Vindas-Guerrero S. Embolismo pulmonar. Rev Médica Sinerg. 2017;2(5):8-14.
12.
Righini, Marc; Goehring, Catherine; Bounameaux, Henri; Perrier A. Effects of Age on the
16
Performance of Common Diagnostic Tests for Pulmonary Embolism. Am J Med. 2000;109(12):357-61.
13.
Righini M, Van Es J, Den Exter PL, Roy PM, Verschuren F, Ghuysen A, et al. Age-adjusted
D-dimer cutoff levels to rule out pulmonary embolism: The ADJUST-PE study. JAMA - J Am Med
Assoc. 2014;311(11):1117-24.
14.
Schouten HJ, Geersing GJ, Koek HL, Zuithoff NPA, Janssen KJM, Douma RA, et al. Diagnostic
accuracy of conventional or age adjusted D-dimer cut-off values in older patients with suspected
venous thromboembolism: Systematic review and meta-analysis. Br Med J. 2013;346(7910):1-13.
15.
Douma RA, Le Gal G, Söhne M, Righini M, Kamphuisen PW, Perrier A, et al. Potential of an age
adjusted D-dimer cut-off value to improve the exclusion of pulmonary embolism in older patients: A
retrospective analysis of three large cohorts. Br Med J. 2010;340(c1475):1-7.
16.
Pulmonary embolism with Hampton’s hump | Radiology Case | Radiopaedia.org [Internet].
17.
Essien EO, Rali P, Mathai SC. Pulmonary Embolism. Med Clin North Am. 2019;103(3):549-64.
18.
Agnelli G, Becattini C. Acute Pulmonary Embolism. New Engl J Med. 2010;363:266-74.
19.
Howard L. Acute Pulmonary Embolism. Clin Med (Northfield Il). 2019;19(3):243-7.
20. Klok, F. A., Zondag, W., Van Kralingen, K. W., Van Dijk, A. P. J., Tamsma, J. T., Heyning, F.
H., Vliegen, H. W., & Huisman, M. V. (2010). Patient outcomes after acute pulmonary embolism: A
pooled survival analysis of different adverse events. American Journal of Respiratory and Critical
21.
Schouten HJ, Geersing GJ, Koek HL, Zuithoff NPA, Janssen KJM, Douma RA, et al. Diagnostic
accuracy of conventional or age adjusted D-dimer cut-off values in older patients with suspected
venous thromboembolism: Systematic review and meta-analysis. Br Med J. 2013;346(7910):1-13.
22.
Meyer, G., Planquette, B., & Sanchez, O. (2008). Long-term outcome of pulmonary embolism.
17