SÍNDROME DE OVARIO POLIQUÍSTICO, MÁS QUE UNA
ENFERMEDAD REPRODUCTIVA.
POLYCYSTIC OVARY SYNDROME, MORE THAN A REPRO-
DUCTIVE DISEASE
Marcela Kriebel Haehner1 Daniel Morún Calvo2 Alejandro Rodriguez Alfaro3Adriana Zuñiga Villegas4
1, 2, 3 y 4 Médico General, San José, Costa Rica.
Contactos: marcela.kriebel@gmail.com
RESUMEN
El síndrome de ovario poliquístico es una patología compleja caracterizada por hipe-
randrogenismo y anovulación, del cual no se ha podido saber en su totalidad el ori-
gen y fisiopatología que lo compone. Las mujeres con SOP en su mayoría presentan
un fenotipo muy característico, con una variedad de signos y síntomas que llegan a
repercutir en su vida cotidiana. Su diagnóstico se basa en tres criterios fundamen-
tales, los cuales son morfología de ovarios poliquísticos, oligomenorrea o disfunción
ovárica e hiperandrogenismo. Abordar a estas pacientes de una manera integral con
cambios en estilo de vida es la piedra angular de su tratamiento.
Cómo citar:
Kriebel Haehner,
M., Morún Calvo, D.,
Rodríguez Alfaro, A.,
& Zúñiga Villegas, A.
Palabras Clave: Síndrome de ovario poliquístico, hiperandrogenismo, irre-
(2021). SÍNDROME
gularidad menstrual, resistencia a la insulina.
DE OVARIO POLI-
QUÍSTICO. Revista
Ciencia Y Salud, 5(2),
Pág.71-81.
27/ene/2021
01/mrz/2021
7
71
ABSTRACT
Polycystic ovarian syndrome is a complex pathology characterized by hyperandro-
genism and anovulation, of which the origin and pathophysiology of it have not been
fully known. Most women with PCOS have a very characteristic phenotype, with a
variety of signs and symptoms that will have an impact on their daily lives. Its diag-
nosis is based on three fundamental criteria, which are polycystic ovarian morpho-
logy, oligomenorrhea or ovarian dysfunction, and hyperandrogenism. Approaching
these patients in a comprehensive way, with lifestyle changes is the cornerstone of
their treatment.
Keywords: Polycystic ovarian syndrome, hyperandrogenism, menstrual
irregularity, insulin resistance
INTRODUCCIÓN:
El síndrome de ovario poliquístico (SOP) es un trastorno heterogéneo caracterizado por hiperandrogenis-
mo y anovulación crónica; en otras palabras, irregularidad menstrual y niveles elevados de andrógenos.
Es la patología endocrinológica más frecuente que afecta a mujeres jóvenes y se presenta con un amplio
espectro de signos y síntomas. La etiología todavía no es clara, pero es probable que sea una interacción
entre genética y factores ambientales. Esta compleja enfermedad tiene implicaciones adversas, tanto para
la reproducción, como para el metabolismo de las pacientes y afecta entre 6 y 20% de las mujeres en edad
reproductiva. Es un síndrome importante de reconocer y tratar, ya que, debido a sus muchas manifestacio-
nes, puede tener un gran impacto en el bienestar metabólico, cardiovascular, reproductivo y psicológico a
lo largo de la vida (1, 2).
El objetivo de esta publicación es realizar una revisión bibliográfica sobre el síndrome de ovario poliquístico
con el fin de recopilar información sobre su epidemiología, fisiopatología, diagnóstico y tratamiento; y así,
poder brindar un conocimiento más actualizado a los médicos generales para optimizar el manejo y apoyo
que se ofrece a estas pacientes.
MÉTODOS
La búsqueda para la revisión sistemática de este tema se hizo en bases de datos como PubMed, UpToDate,
The Cochrane y New England Journal of Medicine. Los criterios de inclusión fueron publicaciones recientes,
desde el 2016 al 2021, con las palabras clave “polycystic ovarian syndrome”, “síndrome de ovario poliquís-
tico”, “hiperandrogenismo”, “irregularidad menstrual” y “resistencia a la insulina”, en el idioma español e
inglés. Se revisaron 17 artículos, que cumplen con los puntos esenciales sobre el tema; sin embargo, se ex-
cluyó uno debido a que fue publicado en el 2015.
72
EPIDEMIOLOGÍA
Múltiples factores están asociados con la heterogeneidad fenotípica del SOP, incluida la obesidad, la raza
y la etnia.
Genética y factores endógenos: Actualmente, todavía no se entiende completamente la genética detrás
del SOP, pero se cree que tiene un rol importante desde el embarazo. Investigaciones han reportado una
exposición excesiva a andrógenos desde la vida fetal hasta la pubertad, acompañado de irregularidades en
la hormona luteinizante y resistencia a la insulina (3).
Adicionalmente, se ha evidenciado que un gran número de pacientes con esta patología tiene historia fa-
miliar o personal de diabetes, e inclusive la mayoría llega a tener una resistencia a la insulina independiente
del peso corporal. Esto se ha relacionado a mini satélites en el gen de la insulina, y a variaciones en los re-
ceptores de la expresión de estrógenos en la granulosa y células de la teca en los ovarios. Esto da a relucir
que existen diferentes apariencias fenotípicas del SOP al interactuar con factores endógenos o ambientales
de cada persona (3).
Obesidad: Con respecto al peso de las pacientes, se ha percibido que de 50 a 80%, presenta sobrepeso u
obesidad. Varios estudios sugieren que en las mujeres con SOP son más importantes los impactos metabó-
licos por la distribución de grasa corporal, en especial la obesidad centrípeta, que el peso en sí o el índice de
masa corporal (IMC). Incluso, parece que la oligomenorrhea e hiperandrogenismo en la adolescencia tienen
un mayor riesgo de desarrollar obesidad (IMC > 40kg/m2) para los 24 años. Con esto, se insinúa una aso-
ciación temporal de SOP con aumento de peso incluso si no existe una predisposición primaria a la misma.
Por otro lado, la evidencia propone que existe un incremento en el tamaño de los adipocitos subcutáneos
en mujeres obesas con ovarios poliquísticos; además, de presentar anormalidades funcionales en su tejido
adiposo, como lo es una disminución en los efectos lipolíticos de las catecolaminas y niveles circulantes
más bajos de adiponectina. No obstante, no está del todo claro si la patología está asociada con cambios
en la composición corporal, lo que puede exacerbar aún más los aspectos reproductivos y metabólicos del
fenotipo de la persona (3, 4).
Nutrición y ejercicio: Un elemento importante para disminuir la severidad de la expresión fenotípica del SOP
es la pérdida de peso. Sin embargo, la mayoría de los estudios evidencian que solamente el ejercicio es in-
suficiente para mejorar los síntomas, por lo que se debe abordar de una manera integral con cambios hacia
un estilo de vida saludable. Hasta el momento, no existe evidencia clara de que haya defectos adicionales
vinculados con el gasto de energía que predispongan a las pacientes con SOP a alterar su capacidad para
perder peso (4).
Se ha tomado en cuenta que la reducción en los niveles de insulina podría dar como solución la disminución
del peso. No obstante, no se ha podido comprobar debido a que investigaciones farmacológicas acerca del
uso de metformina mostraron efectos reductores en niveles de insulina, pero no un patrón consistente en
la pérdida de peso (4).
Con respecto a la parte nutricional, se ha visto que una dieta moderada en carbohidratos, grasas (mono y
polisaturadas) y un alto contenido en fibra y proteínas magras han dado buenos resultados para una mejor
salud en estas pacientes. Debido a esto, la recomendación ideal es una intervención en el estilo de vida,
entiéndase alimentación y ejercicio, debido a que ayuda a recuperar los niveles de hormona folículo esti-
mulante, globulina ligadora de hormonas sexuales, androstenediona, testosterona y a mejorar la resistencia
de insulina (3).
73
Etnia y raza: Este síndrome es una enfermedad común que afecta el sistema endocrino en numerosos
grupos raciales y étnicos. Dentro de su historia, se cree que presenta un rasgo evolutivo antiguo, ya que
fueron encontrados dos loci genéticos replicados en mujeres de ascendencia europea. En mujeres de
América del Norte y del Sur, islandesas, europeas, asiáticas del sudeste, chinas, neozelandesas y mujeres
de Oriente Medio, producen variaciones étnicas en la expresión fenotípica. Inclusive, se ha observado
que las afrodescendientes tienen más probabilidades de presentar hipertensión y factores de riesgo de
enfermedad cardiovascular; contrario a las hispanas quienes son más propensas a sufrir síndrome me-
tabólico y diabetes mellitus tipo 2. Asimismo, puede no haber diferencias importantes en características
reproductivas o metabólicas en poblaciones más jóvenes (3, 4).
Factores ambientales: A diario, las pacientes son expuestas a diferentes químicos que pueden tener
propiedades estrogénicas, antiestrogénicas, androgénicas o anti androgénicas, que pueden contribuir
como agravantes del síndrome. Inclusive, esta exposición se puede dar desde la vida intrauterina. Los
plastificantes, objetos comúnmente utilizados en las casas como comida empacada en envases plás-
ticas, uso de vasos plásticos desechables, frutas con cáscaras, el fumado y consumo de alcohol, se
han relacionado en varios estudios con alteraciones en la pubertad, obesidad y disfunción ovárica; sin
embargo, su relación con la enfermedad debe ser estudiada más a fondo para conocer las alteraciones
que estos ocasionan. De igual manera, un agente que puede contribuir a la patogénesis del SOP es el
bisfenol A, el cual a niveles elevados limita el estrógeno debido a que es un compuesto que lo simula
en el cuerpo, creando un ambiente de exceso estrogénico en las mujeres afectadas. Se ha observado
que tiene cualidades obesogénicas al afectar la función metabólica haciendo que el paciente sea más
propenso a la obesidad. Adicionalmente, se ha observado que la exposición del bisfenos A en el estado
perinatal interrumpe la función ovárica y por ende la reproductiva. Por último, ha sido vinculado con un
metabolismo anormal de glucosa en ratas (3, 4).
Riesgo Cardiovascular: El riesgo cardiovascular de las pacientes con SOP es mayor que en mujeres que
no padecen este síndrome, en especial las que presentan un peso corporal más elevado. La mayoría
presenta en algún momento de sus vidas diabetes mellitus tipo 2 y dislipidemia con bajas concentra-
ciones de lipoproteínas de alta densidad (HDL) y aumento de triglicéridos y lipoproteínas de baja den-
sidad (LDL). Adicionalmente, estudios han asociado esta patología con marcadores como aumento en
la masa del ventrículo izquierdo, disfunción endotelial y rigidez arterial; siendo más susceptibles a una
enfermedad vascular subclínica. Sin embargo, datos sugieren que las mujeres con SOP experimentan un
aumento en las tasas de eventos cardiovasculares, probablemente por la aparición tardía de estos y los
escasos estudios que han incluido a este grupo de pacientes (4).
Riesgo de Cáncer: Estas pacientes poseen riesgo aumentado de padecer cáncer endometrial por facto-
res como obesidad, anormalidades metabólicas e historia prolongada de exposición a estrógenos por
su oligomenorrea (3, 4).
Desórdenes Psicosociales: Las estrategias para poder combatir la obesidad y mitigar los efectos que
esta conlleva requieren un compromiso muy grande, especialmente en estas pacientes. Esto se puede
ver comprometido si existe alguna enfermedad mental o emocional de fondo. Asimismo, el aumento de
peso en SOP generalmente se acompaña de características como hirsutismo, irregularidad menstrual
y problemas con la fertilidad, que agravan ya el enlace que existe entre la obesidad, la parte mental y
emocional de la persona. Por esta razón, pacientes con SOP son más prevalentes de tener un desorden
psicosocial (5).
La prevalencia de depresión, ansiedad y una imagen corporal negativa es mayor en este grupo, y estas con-
diciones son capaces de afectar la calidad de vida de las pacientes. La imagen corporal y poco autocontrol
74
son predictores de estas patologías; y un mayor tiempo de atraso al diagnóstico se asocia con un peor es-
tado psicológico. Se ha asociado también con el trastorno de bipolaridad y su tratamiento (4, 5).
Fisiopatología
El SOP es un círculo vicioso que se perpetúa a sí mismo e involucra disfunción neuroendocrina, metabólica
y ovárica. Comienza a desarrollarse en los primeros años de la pubertad y la característica principal es el
hiperandrogenismo clínico y bioquímico; síntomas presentes en más del 80% de pacientes (1, 6).
La androstenediona es el principal precursor de la síntesis de testosterona y estrógeno en ovarios y corte-
za de la glándula suprarrenal. En el ovario, la conversión de androstenediona a testosterona ocurre en las
células de la teca, y posteriormente es convertida a estrógenos en las células de la granulosa por medio de
una enzima llamada citocromo P450 aromatasa. En las pacientes con SOP, la alteración bioquímica más
común es la elevación de testosterona y andrógenos plasmáticos, a causa de anormalidad intrínseca en
la alteración de la producción estrogénica y consecuentemente aumento en la biosíntesis de andrógenos.
Se ha demostrado una hiperfunción esteroidogénica en células teca aisladas de mujeres con SOP, lo que
evidencia que las células teca en estas pacientes liberan más andrógenos que en las mujeres sanas como
resultado de una expresión regulada al alza de enzimas esteroideas (6).
Además, se ha reportado una desregulación neuroendocrina que puede contribuir a una mayor producción
de andrógenos en el ovario y participar en la patogénesis de este trastorno. Estas pacientes exhiben nive-
les elevados de la hormona luteinizante (LH), en comparación con los de la hormona folículo estimulante
(FSH), a causa de un incremento en la frecuencia y amplitud de pulsación en la liberación de esta hormona
por parte de la hipófisis. Dicha alteración ha atribuido principalmente a un defecto en los mecanismos re-
guladores de la liberación de LH por los esteroides sexuales (5). En consecuencia, el hiperandrogenismo
persistente se asocia con retroalimentación hipotalámica-hipofisiaria deteriorada, hipersecreción de LH,
luteinización prematura de las células de la granulosa, maduración aberrante de los ovocitos y detención
prematura de los folículos primarios activados (1).
La resistencia a la insulina es el trastorno metabólico más frecuente en mujeres con SOP, afectando apro-
ximadamente 65 a 70% de ellas. Esta va de la mano con la hiperinsulinemia debido a que se requiere una
mayor cantidad de insulina para lograr sus efectos metabólicos. La hiperinsulinemia contribuye a la ano-
vulación dependiente de andrógenos a través de diferentes mecanismos. La insulina aumenta los efectos
estimulantes de la LH sobre la producción de andrógenos en las células de la teca ovárica y se ha propuesto
que actúa como una co-gonadotropina y estimula la biosíntesis de andrógenos en el ovario al activar la ex-
presión y actividad de P450c17 en las células teca. Igualmente, las células teca en mujeres con SOP son más
sensibles a los efectos hiperandrogénicos de la insulina que las mujeres sanas (6).
Recientemente, varios estudios han demostrado que existe una correlación entre el estrés oxidativo y el
SOP. La evidencia indica que en esta patología hay un elevado estrés oxidativo y una disminución en an-
tioxidantes, lo cual conforma parte de su fenotipo en el área de obesidad, resistencia a la insulina, inflama-
ción e hiperandrogenismo. Además, este fenómeno puede estar asociado con el incremento en el riesgo
que tienen las pacientes a padecer síndrome metabólico (7).
MANIFESTACIONES CLÍNICAS
El Síndrome de Ovario Poliquístico es considerado una enfermedad multifacética con un espectro de ma-
nifestaciones que afectan no solo mujeres en edad fértil, sino también adolescentes y posmenopáusicas.
Clínicamente se presenta con oligomenorrea y signos de hiperandrogenismo como hirsutismo, acné exce-
sivo y crecimiento de vello en patrón masculino. De igual manera, se presentan menstruaciones irregulares,
75
anovulación crónica, ovarios de aspecto poliquístico al ultrasonido pélvico e infertilidad, como descrito
posteriormente en el apartado de diagnóstico (1, 8).
Los signos de un exceso de andrógenos más severo (virilización) como la profundización de la voz y la cli-
toromegalia, ocurren raramente y sugieren la posibilidad de hiperthecosis ovárica o un tumor secretor de
andrógenos (9).
Las consecuencias metabólicas se presentan como una alteración en la tolerancia a la glucosa que puede
llevar a diabetes mellitus tipo 2, obesidad, dislipidemia, hipertensión arterial y un incremento en el riesgo
cardiovascular como antes fue mencionado (8).
En el embarazo, un meta-análisis demostró una mayor incidencia de diabetes mellitus gestacional, hiper-
tensión inducida en el embarazo, parto pretémino y pequeño para edad gestacional. Sin embargo, no hubo
impacto significativo en el riesgo de parto por cesárea, parto vaginal quirúrgico y grande para la edad
gestacional. Los datos sobre el impacto de SOP en el embarazo en los resultados fetales y neonatales pos-
teriores son limitados y no concluyentes (10).
DIAGNÓSTICO
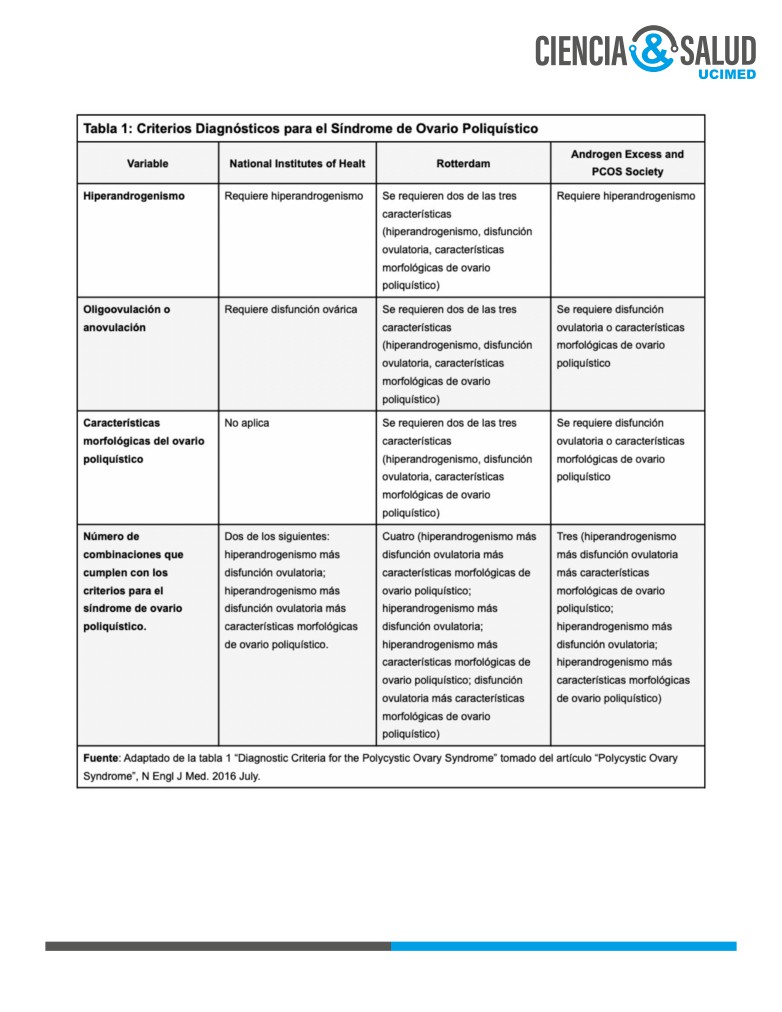
El diagnóstico se realiza con base en uno de tres criterios diagnósticos establecidos (Tabla 1). Cada uno de
estos involucra diferentes pautas, entre ellas hiperandrogenismo, disfunción ovárica y la morfología poli-
quística de los ovarios (3).
El hiperandrogenismo se puede evidenciar tanto por clínica como por análisis bioquímicos. Las manifes-
taciones clínicas más frecuentes son el hirsutismo, crecimiento anormal de vello en patrón masculino y el
exceso de acné. Asimismo, se pueden tomar muestras de los niveles de testosterona plasmática para de-
mostrar el aumento en esta hormona androgénica. Los limites superiores normales de testosterona sérica
normal en mujeres adultas es de 40-60ng/dL, mientras que en pacientes con SOP presentan concentracio-
nes en un rango desde 29 a 150mg/dL. Se puede decir que una testosterona sérica total y/o libre elevada
en cualquier momento del día proporciona evidencia de hiperandrogenismo en un ciclo anovulatorio; pero
un nivel normal en la tarde no excluye la hiperandrogenemia (3, 9).
La disfunción ovárica se define como menstruaciones impredecibles que ocurren en intervalos menores a
21 días o mayores a 35 días. No obstante, 15 a 40% de las pacientes con hiperandrogenismo puede tener
menstruaciones regulares y disfunción ovárica al mismo tiempo (3).
Como último criterio, la morfología poliquística del ovario se caracteriza por tener 12 o más folículos antra-
les de 2-9mm de diámetro en uno o ambos ovarios, un ovario con volumen mayor a 10 mililitros o ambos.
Sin embargo, para evidenciar la presencia de quistes en los ovarios se requiere un personal especializado
en ultrasonido, por lo que no se requiere de este parámetro para hacer el diagnóstico de SOP si la paciente
tiene hiperandrogenismo y disfunción ovárica (3).
76
Las indicaciones para evaluar a adolescentes por SOP engloban un grado anormal de hirsutismo o acné
vulgaris, hirsutismo focal y anormalidad menstrual. La acantosis nigricans (hiperpigmentación café oscuro
acompañada de engrosamiento de la piel y textura aterciopelada localizada en pligues de la piel como el
cuello, axilas, frente, fosa antecubital y poplítea, ingle y ombligo) y/o la obesidad son manifestaciones de
resistencia a la insulina y síndrome metabólico que pueden ser el motivo de presentación de la enfermedad
(9, 11).
Actualmente, el SOP es considerado como una condición médica que perdura toda la vida, la cual se puede
diagnosticar desde la preconcepción al identificar las portadoras de este síndrome. Se han investigado loci
susceptibles a SOP que pueden ser la razón de que exista una predisposición familiar y una variable clínica
que incluye anormalidades neuroendocrinas, reproductivas y metabólicas. Además, interacciones mater-
no-fetales permiten obtener signos tempranos de hiperandrogenismo en hijas de portadoras. Esto permite
observar que no solo puede ser heredable, sino también que la sobreexposición de andrógeno in utero
permite influenciar en una actividad reguladora de la liberación de gonadotropinas, desarrollo folicular, es-
teroidogénesis ovárica y homeostasis de la glucosa e insulina (12).
No obstante, el diagnóstico en la infancia y niñez es casi imposible debido a que no hay signos ni síntomas
evidentes; sin embargo, en la pubertad estas características del síndrome pueden ser más evidentes. Mucho
de lo representativo del SOP evoluciona y cambia durante los primeros años, el reto está en que la pre-
sencia de ciclos anovulatorios, el hiperandrogenismo o hallazgos ultrasonográficos de poliquistosis ovárica
pueden no ser evidentes en adolescentes (12, 13).
TRATAMIENTO
Pacientes con SOP pueden presentar múltiples anormalidades y alteraciones metabólicas que son conside-
radas como factores de riesgo (obesidad, resistencia a la insulina, dislipidemia e intolerancia a la glucosa).
En efecto, el tratamiento más importante y de primera línea en la mayoría de las pacientes con esta pato-
logía es la pérdida de peso porque se ha demostrado que puede restaurar los ciclos ovulatorios y mejorar
el riesgo metabólico (14).
La meta para estas pacientes es disminuir las características hiperandrogénicas, disminuir el riesgo cardio-
vascular y de desarrollar diabetes tipo 2, prevenir una hiperplasia endometrial y carcinoma (ocurre por el
resultado de la anovulación crónica), anticonceptivos orales para aquellas pacientes que no busquen un
embarazo, así como inducir ovulación en aquellas que desean un embarazo (14).
El primer paso en el tratamiento está relacionado con los cambios en el estilo de vida como realizar dieta
y ejercicio. Posteriormente, se debe elegir el tratamiento adecuado dependiendo de los síntomas de cada
paciente (14).
En el 2020, se realizó una revisión sistémica de los efectos del ejercicio a nivel hormonal en pacientes con
SOP, donde se compararon resultados de diferentes actividades físicas como ejercicio aeróbico, entrena-
miento a intervalos de alta intensidad, entrenamiento de resistencia progresiva o de fuerza, yoga, entre
otros. En este se evidenció cómo cada tipo de actividad altera en cierta medida el nivel de hormonas
en estas mujeres; por ejemplo, el ejercicio aeróbico, especialmente consistente y a largo plazo, ayuda a
mejorar la sensibilidad a la insulina. No obstante, entrenamientos de resistencia y fuerza son los que han
demostrado una mejora en los andrógenos. Con respecto a prácticas que han venido en auge, como lo es
el yoga, parece que pueden tener un impacto positivo con respecto a la sensibilidad de insulina y niveles
de andrógenos; pero se requieren más estudios. Debido a esto, es importante considerar el ejercicio físico
constante en pacientes con esta patología, inclusive se ha visto que el tipo de ejercicio a realizar puede ser
variado y siempre es beneficio (15).
78
Los anticonceptivos orales combinados son la terapia farmacológica de primera elección para pacientes
con hiperandrogenismo y disfunción menstrual, además para la prevención del embarazo. Estos se han
asociado con un aumento del tromboembolismo venoso en todas las usuarias, pero especialmente las que
padecen de obesidad y es algo que se debe tomar en cuenta (14).
En los pacientes que presentan resistencia a la insulina/diabetes tipo 2, las biguanidas (metformina) y
tiazolidenidionas (pioglitazona, rosiglitazona) pueden reducir los niveles de insulina en estas pacientes.
Asimismo, estos fármacos pueden reducir la producción de andrógenos en el ovario y así restaurar el ciclo
menstrual normal. La metformina no se recomienda como primera línea de tratamiento en esta patología
ya que su uso no está aprobado para el SOP, no obstante, es un tratamiento comúnmente prescrito para
este síndrome (16).
CONCLUSIÓN
El síndrome de ovario poliquístico es una entidad compleja, con afectación no solo endocrinológica sino
también con impacto global en la vida de las mujeres. En su mayoría las pacientes suelen presentar peso
corporal elevado, aumento en el riesgo cardiovascular y hasta desórdenes psiquiátricos, razón por la cual
es de vital importancia el abordaje de las pacientes de una manera integral, para lograr un estilo de vida
saludable y un impacto positivo tanto a nivel nutricional como psicológico.
El SOP cuenta con una fisiopatología que involucra disfunción neuroendocrina, metabólica y ovárica siendo
su principal característica el hiperandrogenismo. En cuanto a manifestaciones clínicas, es una enfermedad
multifacética que presenta oligomenorrea con ciclos anovulatorios y signos de hiperandrogenismo como
hirsutismo, acné excesivo y crecimiento de vello en patrón masculino. Su diagnóstico se basa en tres cri-
terios: morfología de ovarios poliquísticos, oligomenorrea o disfunción ovárica e hiperandrogenismo. En lo
que al tratamiento se refiere, el primer paso es un cambio en el estilo de vida con alimentación adecuada
y ejercicio, se reservan los anticonceptivos orales combinados para pacientes con hiperandrogenismo y
disfunción menstrual, además para la prevención del embarazo. Se puede decir que es un claro ejemplo de
una enfermedad transgeneracional con mecanismos genéticos y epigenéticos desde la edad prenatal hasta
la adultez.
REFERENCIAS BIBLIOGRÁFICAS
1.
Feldman Witchel S., Oberfield SE., Peña AS. Polycystic Ovary Syndrome: Pathophysiology, Pre-
sentation, and Treatment With Emphasis on Adolescent Girls.
[Internet]. Journal of the Endocrine
Society, August 2019 doi: 10.1210/js.2019-00078. Consultado el 12 de junio, 2020. Disponible en: ht-
2.
Chen Yi Lua A., How How C., King TFJ. Managing polycystic ovary syndrome in primary care
3.
Kshetrimayum C., Sharma A., Mishra VV., Kumar S. Polycystic ovarian syndrome: Enviromen-
79
tal/occupational, lifestyle factors; an overview. J Turk Ger Gynecol Assoc 2019; 20:255-63. DOI:
PMC6883751/pdf/JTGGA-20-255.pdf Consultado el 5 de marzo, 2021.
4.
Mc Cartney CR., Marshall JC. Polycystic Ovary Syndrome [Internet]. N Engl J Med. 2016 July 07;
375(1): 54-64. doi:10.1056/NEJMcp1514916. Consultado el 12 de junio, 2020. Disponible en: https://
5.
Barber TM., Hanson P., Weickert MO., Franks S. Obesity and Polycystic Ovary Syndrome: Im-
plications for Pathogenesis and Novel Management Strategies. Clinical Medicine Insights: Reproduc-
tive Health.5 de Agosto, 2019. httOpsI:/1/d0o.i1.o1rg7/71/01.1177975/15187191595817149084724042.
Consultado el
01 de marzo,
PMC6734597/pdf/10.1177_1179558119874042.pdf
6.
Sanchez-Garrido MA., Tena-Sempere M. Metabolic dysfunction in polycystic ovary syndrome:
Pathogenic role of androgen excess and potential therapeutic strategies [Internet]. Elsevier GmbH,
7.
Zhang J., Bao y., Zhou X., Zheng L. Polycystic ovary syndrome and mitochondrial dysfunc-
tion. Reprod Biol Endocrinol. 2019; 17: 67. Published online 2019 Aug 16. doi: 10.1186/s12958-019-
PMC6698037/
8.
Ashraf Ganie M., Vasudevan V., Ahmad Wani I., Salem Baba M., Arif T., Rashid A. Epidemiology,
pathogenesis, genetics & management of polycystic ovary syndrome in India [Internet]. Indian J Med
Res 150, October 2019, pp 333-344, DOI: 10.4103/ijmr.IJMR_1937_17. Consultado el 13 de junio, 2020.
9.
Rosenfiels RL. Diagnostic evaluation of polycystic ovary syndrome in adolescents. Up to date.
Actualizado el 20 de marzo, 2020. Consultado el 13 de junio, 2020.
10.
Hai-Feng Yu., Hong-Su Chen, Da-Pang Rao, Jian Gong. Association between polycystic ovary
syndrome and the risk of pregnancy complications A PRISMA-compliant systematic review and
gov/pmc/articles/PMC5181798/
11.
Popa M-L., Popa AC., Tanase C., Gheorghisan-Galateanu A-A. Acanthosis nigricans: To be
80
or not to be afraid (Review). Received July 3, 2018; Accepted August 14, 2018 DOI: 10.3892/
cles/PMC6444334/pdf/ol-17-05-4133.pdf
12.
Aversa A, La Vignera S, Rago R, Gambineri A, Nappi RE, Calogero AE and Ferlin A (2020)
Fundamental Concepts and Novel Aspects of Polycystic Ovarian Syndrome: Expert Consensus Re-
solutions. Front. Endocrinol. Publicado el 11 de Agosto, 2020 11:516. doi: 10.3389/fendo.2020.00516.
PMC7431619/pdf/fendo-11-00516.pdf
13.
Agapova SE., Cameo T., Sopher AB., Oberfield SE. Diagnosis and Challenges of Polycystic
Ovary Syndrome in Adolescence. Semin Reprod Med. 2014 May; 32(3): 194-201. Published online
2014 Apr 8. doi: 10.1055/s-0034-1371091. Consultado el 01 de marzo, 2021. Disponible en: https://
14.
Barbieri RL., Ehrmann DA. Treatment of polycystic ovary syndrome in adults. Up to date [In-
ternet]. Actualizado el 17 de julio, 2019. Consultado el 13 de junio, 2020.
15.
Shele G., Genkil J., Speelman D. A Systematic Review of the Effects of Exercise on Hormo-
nes in Women with Polycystic Ovary Syndrome. J. Funct. Morphol. Kinesio [Internet]. 2020, 5, 35;
nih.gov/pmc/articles/PMC7739243/pdf/jfmk-05-00035.pdf
16.
Barbieri RL., Ehrmann DA. Metformin for treatment of the polycystic ovary syndrome. Up to
date. Actualizado el 27 de agosto, 2018. Consultado el 13 de junio, 2020.
81